|
|
||
|
||
|
On réalise le montage ci-dessous. Le générateur de tension continue permet de faire circuler un courant d'intensité I. 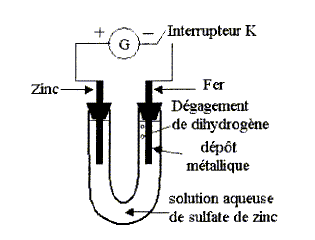
corrigé bilan des espèces présentes dans le milieu : A l'anode, reliée à la borne positive du générateur : zinc métal de l'électrode, Zn2+, SO42-, H2O. A la cathode de fer : fer de l'électrode, Zn2+, SO42-, H2O. sens de circulation des porteurs de charge dans la solution et dans les fils de connexion : dans le circuit extérieur, les électrons vont du pôle - vers le pôle + du générateur. Dans la solution, les ions sulfates SO42- se déplacent du fer vers l'électrode de zinc ; les ions Zn2+ se déplacent du zinc vers l'électrode de fer. demi-équations des réactions se produisant à l'électrode de fer : réduction donc cathode Zn2+ + 2e- = Zn(s) et 2H2O + 2e- = H2 (g) + 2HO-. Intérêt pratique de ce dépot métllique sur lélctrode de fer : protection du fer contre la corrosion. demi-réaction qui se produit sur l'électrode de zinc : oxydation donc anode Zn(s) = Zn2+ + 2e- ; la masse de l'électrode diminue. Le générateur délivre un courant d'intensité I= 0,5 A pendant t=10 min. Quantité d'électricité Q échangée pendant 10 min : Q=It = 0,5*60*10 = 300 C Valeur absolue de la charge d'une mole d'électrons : NA e = 6,02 1023 * 1,6 10-19 =9,632 104 C Quantité de matière d'électrons échangée ne = 300 / 9,632 104 =3,11 10-3 mol Relation entre la quantité de matière de zinc ayant disparu et la quantité d'électrons échangés : Zn(s) = Zn2+ + 2e- ; d'où n(Zn) = ½ne = 3,11 10-3 /2 = 1,56 10-3 mol Diminution de masse de l'électrode de zinc : n(Zn)
M = 1,56 10-3 *65,4 = 1,02
10-1 g.
|
||
|
|
||
|
|