|
|
||
|
||
|
Ca : 40 ; C : 12 ; O : 16 g/mol L'équation de la réaction est : Ca2+ + CO32- + 2(H+ + Cl-) = CO2 + H2O+ Ca2+ +2Cl- masse de carbonate de calcium dissoute avec 1L de solution d'acide chlorhydrique de concentration C= 11 mol/L : quantité de matière d'acide (mol) = volume (L) * concentration (mol/L) =1*11 = 11 mol Ca2+ + CO32- + 2(H+ + Cl-) = CO2 + H2O+ Ca2+ +2Cl- D'après les coefficients de l'équation, la quantité de matière de carbonate de calcium est égale à la moitié de la quantité de matière d'acide soit 5,5 mol. Masse molaire CaCO3 : M= 40 +12+3*16 = 100 g/mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) = 100 *5,5 = 550 g.
Le facteur de dilution est égal à : F= 500/5 = 100 ; la solution diluée est 100 fois moins concentrée que la solution commerciale et son pH est voisin de1. On note c la concentration de la solution diluée et C la concentration de la solution du commerce. pH = 1= - logc d'où c = 0,1 mol/L et C= 100*0,1 =
10
mol/L.
L'indicateur coloré change de couleur à l'équivalence ( passage du jaune au bleu). L'indicateur coloré permet de repèrer l'équivalence. La solution titrante est une solution d'hydroxyde de sodium de concentration cb=0,10 mol/L. Le volume de solution titrante nécessaire pour atteindre l'équivalence est 10,8 mL : à l'équivalence caVa = cbVb soit ca= cbVb / Va =0,1*10,8/10 = 0,108 mol/L et C= 100*0,108 = 10,8 mol/L L'indication portée par l'étiquette est
correcte ( écart relatif =(11-10,8)/10,8 *100 = 2 %
)
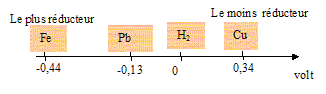
H3O+/H2 : V ; Fe2+/Fe : -0,44 V ; Cu2+/Cu : 0,34 V ; Pb2+/Pb : -0,13 V.
Il est possible d'utiliser l'acide chlorhydrique pour détartrer une canalisation de cuivre (H3O+ n'attaque pas le cuivre) ; par contre le plomb et le fer ( fonte) sont des métaux plus réducteurs que H3O+ : en conséquence le plomb et le fer sont attaqués par H3O+ ; le détartrage par l'acide chlorhydrique n'est pas possible dans ce cas.
|
||
|
|