|
||
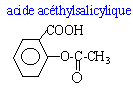
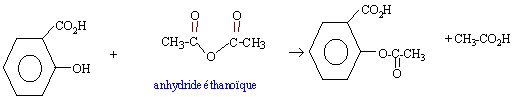
équation bilan de cette réaction :
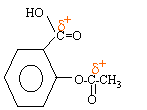
La molécule d'acide acéthylsalicylique présente des sites électrophiles : L'atome de carbone du groupe ester et celui du groupe acide carboxylique sont déficitaires en électrons : ce sont des sites électrophiles, porteurs de la charge positive d+ inférieure à la charge élémentaire.
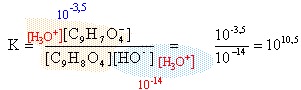
Un comprimé d'aspro 320 est soigneusement broyé puis dissout dans V0=250 mL d'eau. On prélève VB = 100 mL de la solution S obtenue et l'on dose ce prélèvement avec de la soude à CB=0,1 mol /L. pKa (C9H8O4/ C9H7O4-) = 3,5 La réaction de dosage acide base, de constante K, s'écrit : C9H8O4 + HO- --> C9H7O4- + H2O
La constante K est supérieure à 5000, la réaction du dosage est totale.
|
||
|
Le pH du milieu réactionnel à l'équivalence est 7,8. On a réalisé ce dosage en présence d'un indicateur coloré acido basique. Parmi les indicateurs ci dessous quel est celui qui est le mieux adapté ? rouge de crésol : jaune 7,2 - 8,8 rouge ; phénolphtaléine : incolore 8,2 - 10 rose ; hélianthine : rouge 3,1 - 4,4 jaune La zone de virage de l'indicateur coloré le mieux adapté doit contenir le pH du point équivalent soit 7,8. donc rouge de crésol. Lorsque l'indicateur coloré change de teinte, le volume de soude versé vaut 7 mL. Je calcule la masse d'acide acéthylisalicylique contenu dans ce comprimé. M (C9H8O4)= 180 g/mol. A l'équivalence les quantités d'acide et de base mis en présence sont dans les proportions stoéchiomètriques CaVa = CbVb avec Cb = 0,1 mol/L ; Vb = 7 mL ; Va = 100 mL Ca = 0,1*7 /100 = 7 10-3 mol/L. soit 7 10-3 *0,25 = 1,75 10-3 mol dans 250 mL masse = 1,75 10-3 *180 = 0,315 g = 315 mg.
retour - menu |