|
|
||
|
||
|
Un amide N-substitué A, du type R-CO-NH-R1 a une masse molaire M=87 g/mol. Sa composition massique centésimale est : C : 55,2 % ; H : 10,3 % ; O : 18,4 % ; N : 16,1 %.
corrigé formule brute de A : CxHyOzNt 12x / 55,2 = M/100 soit x = 0,87*55,2/12 = 4 ; y/10,3 = M/100 soit y = 0,87*10,3 = 9 16z/18,4 = 0,87 soit z = 0,87*18,4/16 = 1 ; 14t / 16,1 = 0,87 soit t = 0,87*16,1/14 = 1 C4H9ON. L'hydrolyse en milieu basique de A est réalisée en chauffant à reflux le composé A en présence d'une solution d'hydroxyde de potassium. On obtient deux composés organiques : un carboxylate de potassium B et une amine primaire C. R-CO-NH-R1 + K++HO- = R-COO- + K++ R1-NH2. B contient 34,9% de potassium en masse : MB / 100 = MK / 34,9 = 39,1 / 34,9 soit MB= 39,1/0,349 = 112 g/mol. B est R-COO- + K+ ; MB= MR +12+32+39,1 ; MR = 28 ; on identifie R à CH3-CH2- B est CH3-CH2-COO- + K+ : propanoate de potassium B' est l'acide propanoïque : CH3-CH2-COOH C est la méthylamine CH3-NH2. A est le N-méthylpropanamide CH3-CH2 -CO-NH-CH3
|
||
|
Une phéromone est une substance qui, après avoir été secrétée par un insecte, est perçue par un individu de la même espèce chez lequel elle provoque une réaction comportementale. 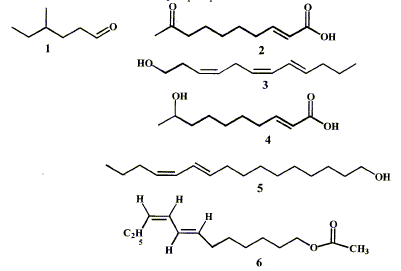
corrigé groupes caractéristiques présents dans les phéromones : 2 : cétone >C=O ; acide carboxylique -COOH ; alcène >C=C< 4 : alcool secondaire C-OH ; acide carboxylique et alcène 6 : ester C-OCO-C et alcènes Pour la phéromone 3 nature Z ou E des doubles liaisons : C4 C5 et C6 C7: Z ( les deux substituants sont du même côté de la double liaison) C8 C9 : E ( les deux substituants sont de part et d'autre de la double liaison) Nom du composé 1 : 4-méthylhexanal ( aldehyde, le groupe >C=O est en bout de chaîne) Le bombyx du murier détecte la phéromone émise 5, le bombykol, par sa femelle dès qu'il y a plus de 192 molécules de bombykol par mL d'air. concentration molaire de cette phéromone correspondant au seuil de détection : 192 000 molécules dans 1L d'air soit 192000/NA = 192000 / 6,02 1023 = 3,2 10-19 mol/L d'air Masse molaire du bombykol C16H30O : M= 238 g/mol ; concentration massique (g/L) = masse molaire (g/mol) * concentration molaire (mol/L) = 238*3,2 10-19 =7,6 10-17 g/L. La phéromone 1 peut être obtenue à partir de l'alcool correspondant par une réaction d'oxydation par le permanganate de potassium. CH3-CH2-CH(CH3)-CH2-CH2-CH2OH ou C7H16O : 4-méthylhexan-1-ol 5 fois {C7H16O= C7H14O + 2H++2e-} oxydation en aldehyde 2 fois{ MnO4- +8H++5e-= Mn2+ + 4H2O} réduction bilan : 5C7H16O + 2MnO4- +6H+= 5C7H14O + 2Mn2+ + 8H2O
|
||
|
|