|
physique chimie : étude cinétique de la synthèse du diiode suivie par spectrophotométrie. |
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
On se propose de déterminer l'ordre et la constante de la réaction d'oxydation des ions iodures par le peroxodisulfate S2O82- en solution aqueuse. Seule le diiode est coloré. E°(I2/I- ) = 0,62 V ; E°(S2O82-/SO42- ) = 2,01 V Des études expérimentales montrent que la vitesse de cette réaction dépend uniquement de la concentration en ions I- et S2O82-. La vitesse de la réaction s'écrit : v = -d[S2O82-]/dt = k[I-]a[S2O82-]b. Cette réaction est étudiée à température ambiante. A l'instant t=0 on mélange un volume V1= 15,0 mL d'une solution de peroxodisulfate d'ammonium de concentration c1 = 6,25 10-3 mol/L et un volume V2 = 25,0 mL de solution d'iodure de potassium de concentration C2 = 0,250 mol/L. - Soit c0 la concentration initiale de S2O82-et c celle de I- dans le mélange. Des mesures de
l'absorbance de la solution en fonction du temps
donnent les résultats suivants
: équation de la réaction entre les ions peroxodisulfate et les ions iodure : 2I- = I2+ 2e- ; E1 = E°(I2/I- ) + 0,03 log ([I2]/[I-]2) S2O82-+ 2e-= 2SO42- ; E1 = E°(S2O82-/SO42- ) + 0,03 log ([S2O82-]/[SO42-]2) 2I- + S2O82- = I2+2SO42- ; K= [I2][SO42-]2 / ([S2O82-][I-]2) à l'équilibre : E1=E2 ; E°(I2/I- ) + 0,03 log ([I2]/[I-]2) = E°(S2O82-/SO42- ) + 0,03 log ([S2O82-]/[SO42-]2) E°(S2O82-/SO42- ) - E°(I2/I- ) = 0,03[log ([I2]/[I-]2) - log ([S2O82-]/[SO42-]2)] E°(S2O82-/SO42- ) - E°(I2/I- ) = 0,03 log [I2][SO42-]2 / ([S2O82-][I-]2) = 0,03 log K log K = (2,01-0,63) / 0,03 = 46,3 ; K = 2 1046. K est très grande : l'équilibre est
fortement déplacé dans le sens direct, vers la
droite ; la réaction est
totale.
c0 = c1V1 / (V1+V2) = 6,25 10-3 * 15/40 = 2,34 10-3 mol/L c = c2V2 / (V1+V2) = 0,25*25/40 = 0,156 mol/L c est très supérieure à c0, on peut considérer que la concentration des ions iodures est constante ( large excès d'ions iodure) La loi de vitesse se simplifie : v
= -d[S2O82-]/dt =
k[I-]a[S2O82-]b
= k'
[S2O82-]b
avec k' = k[I-]a
, constante de vitesse apparente.
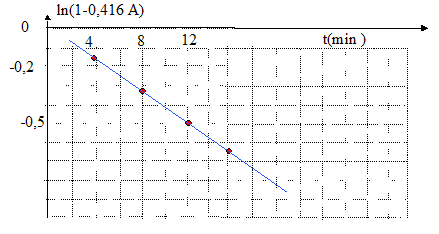
Loi cinétique en [S2O82-]t : -d[S2O82-]/dt =k' [S2O82-] ; d ln[S2O82-] = -k'dt intégrer entre 0 et t : ln[S2O82-]- ln c0 = -k't ; ln ( [S2O82-]/ c0) = -k't ou [S2O82-] = c0 exp(-k't) Pour vérifier la valeur
b
= 1, il faut tracer la courbe d'équation ln (
[S2O82-]/
c0) = f(t), droite passant par l'origine de
coefficient directeur k'.
or [I2]t = c0-[S2O82-]t = c0-c0 exp(-k't) ; [I2]t = c0(1-exp(-k't)) ; At = c0/ K(1-exp(-k't)) At K/c0=1-exp(-k't) ; 1-At K/c0=exp(-k't) ; ln(1-At K/c0) = -k't Détermination de K/c0 : ln(1-A4 K/c0) = -4k' ; ln(1-A8 K/c0) = -8k' ; ln(1-A4 K/c0) - ln(1-A8 K/c0) = 4k' ; ln((1-A4 K/c0) / (1-A8 K/c0) ) = 4k' de même : ln((1-A8 K/c0) / (1-A12 K/c0) ) = 4k' d'où (1-A4 K/c0) / (1-A8 K/c0) = (1-A8 K/c0) / (1-A12 K/c0) (1-0,349 K/c0) / (1-0,67 K/c0) = (1-0,67 K/c0) / (1-0,94 K/c0) La constante K/c0 vaut 0,416. en conséquence : ln(1-0,416At ) = -k't On trace la courbe ln(1-0,416At ) = f(t) : La courbe est une droite ce qui confirme
la valeur b
=1. |
||||||||||||||||||||||||||||||||||||||||||||
|
|