|
CAPES physique chimie ( d'après concours interne 2003 ) Thiosulfate de sodium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Potentiels standard en volts à T=298 K :
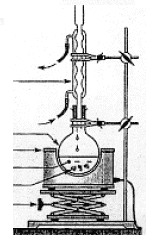
On prépare une solution aqueuse de sulfite de
sodium Na2SO3 de concentration c= 0,50
mol/L. A 50 mL de la solution précédente, on
ajoute 1,5 g de soufre solide. On chauffe à reflux
l'ensemble pendant 1 heure. On constate qu'il reste du
soufre. Après refroidissement, filtration,
séchage, on pèse une masse m de soufre. SO32-/S2O32- : 2 SO32- +4 e- +6H+ = 3H2O + S2O32- réduction E1 = 0,67 + 0,06/4 log ([SO32- ]2[H+]6 / [S2O32-]) S2O32-/S : 2 S +3H2O = S2O32- +4 e- +6H+ oxydation E2 = 0,58 + 0,06/4 log ([S2O32-][H+]6 ) bilan : SO32- +S = S2O32- ; K= [S2O32-] / [SO32- ] à l'équilibre E1=E2 soit : 0,67 + 0,06/4 log ([SO32- ]2[H+]6 / [S2O32-]) = 0,58 + 0,06/4 log ([S2O32-][H+]6 ) 0,09*4/0,06 = log ([S2O32-]2/[SO32- ]2 ; 6 = log K2 ; log K= 3 ; K = 1000 K est suffisamment grand pour que cette réaction d'oxydoréduction soit quantitatiuve.
Données : pKs(AgBr) = 12,30 ; [Ag(S2O3)2]3- = Ag+ + 2S2O32- ; pKd =13,46. avancement de la réaction : Quantité de matière initiale : n(SO32-) = 0,05 * 0,5 = 0,025 mol ; n(S) = 1,5 / 32 = 0,047 mol
si S en défaut : 0,047-xmax = 0 soit xmax =0,047 mol. Quantité de matière n de thiosulfate de sodium formée : n = 0,025 mol ;masse m de soufre restant : 32*0,022 = 0,7 g. Pour vérifier le résultat précédent, on se propose de doser la quantité de matière de thiosulfate contenue dans la solution S' obtenue après filtration. Cette solution S' est amenée à 100,0 mL dans une fiole jaugée, ce qui donne une solution S". A un volume V1 = 10,0 mL de S" on ajoute progressivement une solution de diiode de concentration c2=0,10 mol/L jusqu'à persistance de la coloration jaune qui est obtenue pour un volume V2= 11,8 mL de solution de diiode. Equation de dosage entre le diiode I2 et l'ion thiosulfate : S4O62-/S2O32- : 2 S2O32- = S4O62- + 2e- oxydation I2 aq/I- : I2 aq+2e- = 2 I- réduction d'où : 2 S2O32- +I2 aq = S4O62- +2 I- n(S2O32-) = 2n( I2 aq ) = 2 c2V2=2*0,1*0,0118 = 2,36 10-3 mol dans 10 mL de S" soit n' = 2,36 10-2 mol dans 100 mL de S" soit dans S'. Comparaison avec à la valeur n calculée : l'écart relatif est :(n-n') *100 / n = (2,5-2,36)/100 / 2,5 =5,6 % ( accord entre les résultats à 5,6 % près). En photographie, après la phase de développement qui permet de révéler l'image latente, il est nécessaire d'éliminer les ions argent (I) n'ayant pas réagi avec le révélateur ( cristaux non sensibilisés par lma lumière ). C'est l'opération dite de fixage. Pour cela, on élimine le bromure d'argent insoluble par action du thiosulfate de sodium qui forme des ions complexes dithiosulfatoargent(I), solubles et très stables. Equation de dissolution des cristaux de bromure d'argent par formation des ions complexes dithiosulfatoargent(I) dans une solution de thiosulfate de sodium : Ag+ + 2S2O32- = [Ag(S2O3)2]3- ; avec Kd = [Ag+][S2O32- ]2/[[Ag(S2O3)2]3-] AgBr(s) = Ag+ + Br- avec Ks = [Ag+][Br-] d'où : AgBr(s) + 2S2O32- = [Ag(S2O3)2]3- + Br- avec K= [[Ag(S2O3)2]3-][Br-] / [S2O32- ]2 = Ks /Kd =10-12,3 / 10-13,46 = 101,16 = 14,5. Solubilité s du bromure d'argent si la solution de thiosulfate est de concentration c= 1,0 10-2 mol/L : s = [[Ag(S2O3)2]3-] + [Ag+] Kd = [Ag+][S2O32- ]2/[[Ag(S2O3)2]3-] donne : [Ag+]/[[Ag(S2O3)2]3-] = Kd /[S2O32- ]2 = 10-13,46 / 10-4 = 10 -9,46 = 3,5 10-10. donc [Ag+]négligeable devant [[Ag(S2O3)2]3-] et s = [[Ag(S2O3)2]3-] Le tableau suivant est établi pour 1 L de solution :
xéqui / (0,01-2xéqui) = 14,5½ = 3,81 ; xéqui = 4,42 10-3 ; s = [[Ag(S2O3)2]3-] = 4,42 10-3 mol/L.
Combien peut-on fixer de films photographiques avec 1 L de cette solution sachant qu'il reste environ m'= 120 mg de bromure d'argent sur chaque film après révélation ? n( AgBr)= 0,120 / (108+80) = 6,38 10-4 mol. puis 4,42 10-3 / 6,38 10-4 = 7. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|