|
suite --> acide base ; ester ( concours kiné Rennes 02) |
|||
|
|||
|
L'aspartame est un édulcorant synthétisé en 1965. Sa molécule ne comprend que des atomes de carbone, d'hydrogène, d'oxygène et d'azote. La combustion complète de 0,01 mol d'aspartame donne 1,62 g d'eau La composition massique de l'aspartame est C= 57,14% ; O= 27,22 % ; N=9,52% ; H=6,12 %.
données : masse atomique molaire (g/mol) C=12 ; O=16 ; H=1 ; N=14. corrigé formule brute : CxHyOzNt. masse molaire M = 12x +y+16z+14t dans 1,62 g d'eau il y a 1,62 *2 /18 = 0,18 g d'élément hydrogène.( 0,18 mol) dans 0,01 mol d'aspartame il y a 0,18 mol d'hydrogène donc y = 18. % massique d'hydrogène = 18 / 6,12 = M / 100 d'où M = 294 g/mol % massique de carbone : 12 x / 57,14 = M/100 = 2,94 d'où x =14 %massique d'oxygène : 16z / 27,22 = 2,94 d'où z = 5 %massique d'azote : 14t / 9,52 = 2,94 d'où t = 2 C14H18O5N2.
|
|||
|
Les activités humaines ont considérablement augmenté les concentrations en oxydes d'azote et en oxydes de soufre en particulier le dioxyde SO2 dans l'atmosphère. Sous l'effet du rayonnement solaire ou des orages, ces oxydes se transforment en acides. La norme fixée par l'OMS pour la teneur massique en SO2 (gaz) dans l'atmosphère est 50 mg m-3. Dans l'industrie on dose la teneur en dioxyde de soufre de l'effluent gazeux à la sortie d'une cheminée d'usine, avant son rejet dans l'air libre. Pour cela on fait barboter un volume de gaz de 10 m3 dans une solution d'eau distillée de 250 mL de façon à dissoudre tout le dioxyde de soufre dans l'eau. La solution obtenue, versée dans un erlenmeyer, est dosée par une solution de permanganate de potassium acidifiée de concentration 10-3 mol/L. Pour atteindre l'équivalence, il faut verser 18,8 mL de la solution de permanganate de potassium.
Données : potentiel redox (V) MnO4- /Mn2+ E°=1,51 V ; SO42- / SO2 E° = 0,34 V ; masse molaire (g/mol) S=32 ; O=16.
corrigé 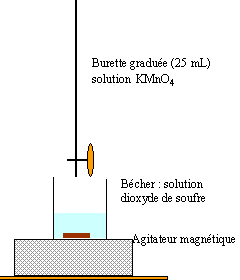
l'oxydant , l'ion permanganate se réduit : 2 fois { MnO4- + 8H+ +5e---> Mn2+ + 4H2O} le dioxyde de soufre s'oxyde : 5 fois {SO2 + 2H2O --> SO42- + 2e-+ 4H+} 2MnO4-+ 16H++5SO2 + 10H2O--> 2Mn2+ + 8H2O + 5SO42- + 20H+ 2MnO4- + 5SO2 + 2H2O--> 2Mn2+ +5 SO42- + 4H+ à l'équivalence les quantités de réactifs mises en présence sont dans les proportions stoéchiomètriques. avant l'équivalence le dioxyde de soufre est en excès ; après l'équivalence l'ion permanganate est en excès. l'ion permanganate de couleur violette, sert à la fois de réactif et d'indicateur de fin de réaction. à l'équivalence : Qté de matière d'ion permanganate : volume (L) * concentration (mol/L = 18,8 10-3 10-3 = 1,88 10-5 mol Qté de matière de dioxyde de soufre : 2,5*1,88 10-5 =4,7 10-5 mol dans 0,25 L de solution soit dans 10 m3 de gaz donc 4,7 10-6 mol dans 1 m3 de gaz masse (g) = Qté de matière (mol) * masse molaire (g/mol) =4,7 10-6 * (32+16+16) = 3,008 10-4 g= 300,4 mg dans 1 m3. ce gaz n'est pas conforme 300,4 étant supérieur à 50 mg dans 1 m3. retour - menu |