|
optique
; magnétisme
; électricité
; chimie
aide
technique
2002
|
|
|
|
optique :
Soient deux lentilles L1 et L2 : la
première a des bords épais et est " creuse "
en son milieu, la seconde porte l'indication +10
dioptries.
- Parmi les grandeurs ci-dessous, entourer celle qui
correspond à l'indication +10 dioptries :
- Puissance ; Vergence ; Distance focale
- La première lentille L1 est-elle :
Convergente ; Afocale ; Divergente
- La seconde lentille L2 est-elle :
Convergente ; Afocale ; Divergente
- On accole les deux lentilles L1 et
L2 et on constate alors que l'image d'un objet
vu à travers cet ensemble est identique à
l'objet.
- Quelle est la vergence de la première lentille
L1 ?
- Quelle est sa distance focale en mètre(s) ?
- Quels sont les dispositifs qui vous permettraient de
produire le phénomène de dispersion parmi
la liste suivante ? Entourer la bonne réponse.
Prisme de verre ; Miroir concave ; Miroirs de Fresnel ;
Réseau.
- Si on envoie sur une cuve contenant un liquide
coloré, les différentes couleurs de l'arc
en ciel, certaines de ces couleurs disparaissent de la
lumière transmise. Quel est le nom de ce
phénomène observé ?
corrigé
la seconde lentille est convergente ( vergence
positive) et sa vergence est 10 dioptries.
la première lentille à bords épais
et centre "creux" est divergente.
l'image donnée par les deux lentilles
accolées et l'objet étant identique, la
vergence de l'ensemble est nulle. Or les vergences de deux
lentilles accolées s'ajoutent C1 +
C2 =0 soit C1 = -10 dioptries.
la distance focale image de L1 est l'inverse
de la vergence soit -1/10 = -0,1m.
Un prisme de verre ou un réseau mettent en
évidence le phénomène de dispersion de
la lumière blanche.
Dans le spectre de la lumière blanche transmise
par le liquide coloré , certaines bandes de couleurs
sont absentes d'où le nom donné : spectre de
bandes d'absorption.
|
|
magnétisme
:
- Comment détecter un champ magnétique
?
- Avec quel appareil mesurer la valeur d'un champ
magnétique ?
- Répondre par vrai ( V ) ou faux ( F ) aux
affirmations suivantes :
- L'unité de champ magnétique est le
Weber.
- Une bobine parcourue par un courant se déplace
si elle est au voisinage d'un aimant.
- Le champ magnétique terrestre est plus grand que
celui créé par un aimant de
haut-parleur.
- On appelle pôle nord d'une boussole celui qui est
pointé vers le nord magnétique
terrestre.
- On peut dévier un faisceau d'électrons
avec un aimant
- On peut approcher un aimant de haut-parleur d'une
disquette informatique sans risque.
corrigé
Une petite boussole s'oriente dans un champ
magnétique et permet donc de détecter un champ
magnétique.
Ce dernier
s'exprime en tesla (T) et sa valeur est mesurée par
un teslamètre.
L'unité de champ magnétique est le
tesla.
- Une bobine parcourue par un courant se comporte comme un
aimant et possède une face nord et une face sud : la
bobine peut donc se déplacer afin de s'orienter dans
le champ de l'aimant ( deux pôles de même nom se
repoussent, de nom contraire s'attirent).
- Le champ magnétique terrestre est plus
petit que celui
créé par un aimant de haut-parleur.
- On appelle pôle nord d'une boussole celui qui est
pointé vers le nord magnétique terrestre.
- On peut dévier un faisceau d'électrons avec
un aimant
-Si on approche un aimant de haut-parleur d'une disquette
informatique on
détruit
l'information écrite sur la disquette.
|
|
connaissance
du matériel et
sécurité
:
Quel est la signification de chaque dessin ?
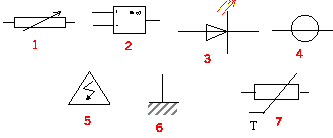
corrigé
(1) résistance variable
(2)
amplificateur opérationnel
(3) diode
électroluminescente (LED)
(4)
générateur idéal de tension
(5) danger :
haute tension
(6 ) mise
à la masse
(7)
thermistance
|
|
mesures
en électricité
:
On veut
contrôler l'exactitude des fréquences
affichées sur un GBF à l'aide d'un
oscilloscope.
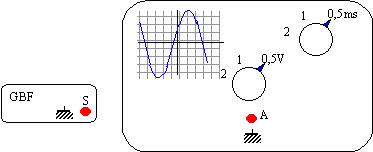
- Indiquer
le branchement à effectuer pour visualiser le
signal sur la voie A en dessinant les fils
nécessaires.
- À
partir des réglages de l'oscilloscope et de
l'oscillogramme représentés ci-dessus,
donner :
- la durée du balayage et la sensibilité
verticale.
- la période du signal et la fréquence de
ce signal.
- l'amplitude du signal.
- On
mesure la tension de sortie du GBF à l'aide d'un
voltmètre numérique : indiquer la valeur
lue.
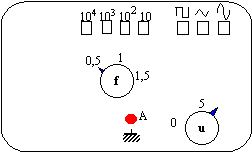
- Un
professeur veut visualiser un signal sinusoïdal de
fréquence de 1200 Hz et d'amplitude d'environ 2,5
V. Sur la façade du GBF ci-dessous, noircir les
touches à enfoncer et positionner l'index des
boutons - curseurs " u " et " f " sur les bonnes
valeurs.
corrigé
relier la masse de l'oscilloscope à la masse du
GBF
relier la
sortie S du GBF à l'entrée A de l'oscilloscope
( bornes rouges)
durée
du balayage : 0,5 ms / div ;
sensibilité
verticale : 0,5 V/ div
période
: 7 divisions soit 7*0,5 = 3,5 ms = 3,5 10-3
s
fréquence
= inverse de la période en seconde soit 1 / 3,5
10-3 = 286
Hz.
amplitude :
environ 4 divisions soit 4*0,5 = 2V.
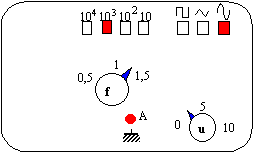
fréquence
: positionner le bouton f sur 1,2 et enfoncer la touche
103.
choisir la
fonction sinusoïdale
le bouton u
sera positionner entre 0 et 5.
|
|
solutions
aqueuses ioniques
:
Pour
étiqueter des flacons contenant les solutions
aqueuses des produits chimiques dont les noms ou les
formules sont données dans le tableau ci-dessous,
compléter le tableau.
|
noms
|
formules
|
état
physique à température et sous
pression ordinaires
|
formule
de la solution aqueuse à écrire sur
l'étiquette
|
|
Permanganate
de potassium
|
KMnO4
|
|
|
|
Acide
sulfurique
|
H2SO4
|
|
|
|
Sulfate
de fer III
|
|
|
|
|
Chlorure
d'hydrogène
|
|
|
|
|
Ethanoate
de sodium
|
CH3COONa
|
|
|
|
Thiosulfate
de sodium
|
Na2S2O3
|
|
|
corrigé
|
noms
|
formules
|
état
physique à température et sous
pression ordinaires
|
formule
de la solution aqueuse à écrire sur
l'étiquette
|
|
Permanganate
de potassium
|
KMnO4
|
solide (noir)
|
KMnO4 ou
K+ ;
MnO4-
|
|
Acide
sulfurique
|
H2SO4
|
liquide
|
H2SO4
|
|
Sulfate
de fer III
|
Fe2(SO4)3
|
solide
|
Fe2(SO4)3
ou 2Fe3+
3SO42-
|
|
Chlorure
d'hydrogène
|
HCl
|
gaz
|
solution acide chlorhydrique
H3O+
Cl-
|
|
Ethanoate
de sodium
|
CH3COONa
|
solide
|
CH3COONa
ou
Na+
CH3COO-
|
|
Thiosulfate
de sodium
|
Na2S2O3
|
solide
|
Na2S2O3
ou
2Na+
S2O32-
|
|
|
solutions
commerciales :
Un flacon
d'acide sulfurique concentré porte les indications :1
L ; H2SO4 ; masse molaire 98 g/mol ;
pourcentage massique 95%; densité d= 1,84.
- Détailler
le calcul conduisant à la valeur approximative Cc
= 18 mol.L-1 de la concentration molaire de la
solution commerciale.
- A partir
de cette solution commerciale, vous devez préparer
2 L de solution d'acide sulfurique à 0,1
mol.L-1. Quel volume Vc de la solution
commerciale allez-vous prélever ?
- Quelle
est la verrerie nécessaire pour réaliser
cette dilution .
- On dose
par conductimétrie 10 mL de cette solution
diluée avec une solution titrée à
0,1 mol.L-1 d'hydroxyde de sodium.
- Quelle est la grandeur électrique mesurée
par un conductimètre ? Préciser son
unité.
- En l'absence de conductimètre, quel circuit
électrique faut-il réaliser ? Le
schématiser.
- Tracer l'allure de la courbe de ce dosage
conductimétrique. Préciser les grandeurs
mesurées le long des axes et indiquer la valeur du
volume atteint à l'équivalence.
corrigé
masse de 1 L de solution : 1,84 kg ou 1840 g
masse
d'acide pur : 1840*0,95 = 1748 g
Qté
de matière dans 1 L ou concentration : 1748 / 98 =
17,83 mol/L.
le facteur
de dilution est de : 18 / 0,1 = 180
donc
prélever 1000 / 180 = 5,6 mL de la solution
mère à l'aide d'une pipette graduée
+pipeteur ou d'une burette graduée
Placer dans
une fiole jaugée de 1L et compléter jusqu'au
trait de jauge avec de l'eau distillée ( la fiole
jaugée doit être au départ remplie
à moitié d'eau distillée avant
d'ajouter les 5,6 mL d'acide concentré)
recommencer
cette opération afin d'obtenir 2 L de solution
diluée.
Le conductimètre mesure la conductance,
exprimée en siemens (S) de la solution
ionique.
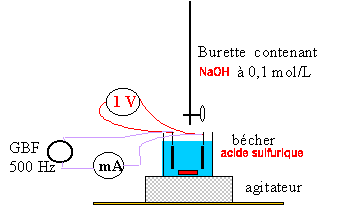
Qté
de matière (mmol) de soude versée à
l'équivalence : 0,1 V ( volume en mL
l'acide
sulfurique est un diacide et libére deux moles d'ion
oxonium par mole d'acide sulfurique :
d'où
la quantité de matière (mmol) d'acide
sulfurique : 0,05 V = 0,1*10 = 1 mmol
soit V =
1/0,05 = 20
mL
de soude ajouté à
l'équivalence.
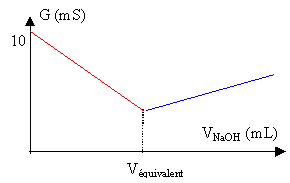
|
|
dosage
acide base
:
Dans une
table de constantes chimiques, on relève les
données ci-dessous (mesures à
25°C).
|
Indicateur
|
Zone
de virage
|
pKI
|
|
Méthylorange(hélianthine)
|
3,1
- 4,4 rouge - orange
|
3,4
|
|
Rouge
de méthyle
|
4.4
- 6.2 rouge - jaune
|
5,0
|
|
Bleu
de bromothymol
|
6,0
-7,6 jaune - bleu
|
7,1
|
|
o-crésolphtaléine(rouge
de crésol)
|
7,4
-9,0 jaune - pourpre
|
8,2
|
|
Phénol
- phtaléine
|
8,2
- 9,8 incolore - rouge
|
9,4
|
|
Jaune
d'alizarine R
|
10,1
- 12 jaune - rouge
|
11,2
|
|
acide
|
base
|
pKa
|
|
H2SO4
|
HSO4-
|
0
|
|
HSO4-
|
SO42-
|
1,9
|
|
H3O+
|
H2O
|
0
|
|
H2O
|
HO-
|
14
|
|
acide formique BH
|
B-
|
3,8
|
|
NH4+
|
NH3
|
9,2
|
- Dans le
tableau ci-dessous /
- Associer aux couples solution à titrer /
solution titrante, l'indicateur qui convient pour
détecter l'équivalence acido-basique, V
étant le volume de solution titrante versé
dans 10 mL de solution à titrer.
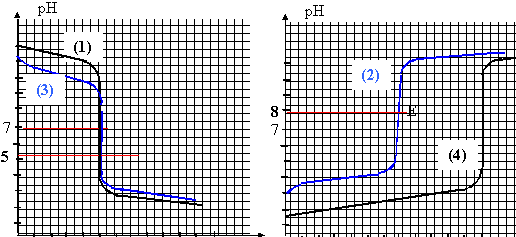
- Choisir le graphe pH = f(V) correspondant au dosage
effectué parmi ceux proposés
ci-dessous.Toutes les solutions sont à 0,1
mol/L
|
Solutionà
titrer
|
Solution
titrante
|
Indicateur
coloré
|
N°
du graphe
|
|
Hydroxyde
de sodium
|
Acide
chlorhydrique
|
|
|
|
Acide
sulfurique
|
Hydroxyde
de sodium
|
|
|
|
Acide
formique
|
Hydroxyde
de sodium
|
|
|
|
Ammoniaque
|
Acide
chlorhydrique
|
|
|
corrigé
|
Solution
à titrer
|
Solution
titrante
|
Indicateur
coloré
|
n°
du graphe
|
|
Hydroxyde
de sodium
|
Acide
chlorhydrique
|
bleu
de bromothymol
|
1
|
|
Acide
sulfurique
|
Hydroxyde
de sodium
|
Phénol
- phtaléine
|
4
|
|
Acide
formique
|
Hydroxyde
de sodium
|
Phénol
- phtaléine
|
2
|
|
Ammoniaque
|
Acide
chlorhydrique
|
Rouge
de méthyle
|
3
|
la zone de virage de
l'indicateur coloré doit contenir le pH à
l'équivalence.
hydroxyde de
sodium ( bécher) et acide chlorhydrique (burette)
:
dosage acide
fort base forte, le pH à l'équivalence est 7 (
bleu de bromothymol )
hydroxyde de sodium ( burette) et acide sulfurique (becher)
:
l'acide
sulfurique est un diacide ( graphe n°4) ; à
l'équivalence la solution contient une base faible
l'ion sulfate, donc le pH est supérieur à 7
(Phénol - phtaléine )
hydroxyde de sodium ( burette) et acide formique (becher)
:
l'acide
formique est un acide faible ; à l'équivalence
la solution contient une base faible l'ion formiate, donc le
pH est supérieur à 7 (Phénol -
phtaléine )
ammoniaque (
bécher) et acide chlorhydrique (burette) :
dosage acide
fort base faible, le pH à l'équivalence
contient un acide faible l'ion ammonium donc pH
inférieur à 7 ( Rouge de méthyle
)
|
|
molécules
organiques
:
Compléter
les cases vides du tableau en indiquant les formules semi -
développées et les noms des molécules
de façon à respecter les règles de
nomenclature systématique.
|
Nom
commercial
|
Formule
semi développée
|
Nom
systématique
|
|
acétone
|
|
|
|
Acétylène
|
|
|
|
Butanol-2
|
|
1-méthylpropan-1-ol
|
|
Acide
formique
|
|
Oxyde
de diéthyle
|
|
Ether
éthylique
|
|
|
|
Formiate
d'éthyle
|
|
méthanoate
d'éthyle
|
sécurité
:
Au
laboratoire sont installées 4 armoires de rangement
pour produits dangereux : une armoire ventilée pour
les acides A, une armoire ventilée pour les bases B,
une armoire à produits toxiques T, une armoire
réfrigérée R.
Complétez
le tableau ci dessous, en précisant dans quelle
armoire stocker ce produit et en indiquant par un adjectif
le(s) risque(s) encouru(s) lors de la manipulation de ce
produit.
|
Produit
à stocker
|
Température
d'ébullition sous pression
ordinaire
|
Point
éclair
|
Armoire
|
Risque
|
|
Acétone
|
56,3°C
|
-
20°C
|
|
|
|
Acide
butyrique
|
163,5°C
|
72°C
|
|
|
|
Anhydride
acétique
|
140°C
|
49°C
|
|
|
|
Chlorure
de mercure II(solide)
|
277°C
|
|
|
|
|
Éthylène
diamine
|
118°C
|
34°C
|
|
|
|
Ethanol
absolu
|
78,5°C
|
12°C
|
|
|
corrigé
|
Nom
commercial
|
Formule
semi développée
|
Nom
systématique
|
|
acétone
|
CH3-CO-CH3
|
propanone
|
|
Acétylène
|
C2H2 (triple liaison
carbone carbone)
|
éthyne
|
|
Butanol-2
|
(CH3)2CH-CH2OH
|
2-méthylpropan-1-ol
|
|
Acide
formique
|
HCOOH
|
acide
méthanoïque
|
|
Ether
éthylique
|
CH3-CH2-O-CH2-CH3
|
Oxyde
de diéthyle
|
|
Formiate
d'éthyle
|
HCOO-CH2-CH3
|
méthanoate
d'éthyle
|
|
Produit
à stocker
|
Température
d'ébullition sous pression
ordinaire
|
Point
éclair
|
Armoire
|
Risque
|
|
Acétone
|
56,3°C
|
-
20°C
|
réfrigérée R
|
inflammable, ne pas inhaler de
vapeurs
|
|
Acide
butyrique
|
163,5°C
|
72°C
|
ventillée A
|
provoque des brûlures
|
|
Anhydride
acétique
|
140°C
|
49°C
|
ventillée A
|
inflammables, provoque des
brûlures
|
|
Chlorure
de mercure II(solide)
|
277°C
|
|
toxique T
|
nocif en cas d'ingestion
|
|
Éthylène
diamine
|
118°C
|
34°C
|
ventillée B
|
inflammable, provoque des brûlures,
nocif (peau , ingestion)
|
|
Ethanol
absolu
|
78,5°C
|
12°C
|
ventillée A
|
inflammable
|
retour
- menu
|






