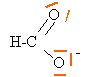|
suite --> alcools et saponification ( concours kiné A.P 02) |
|||||||||||||||
|
|||||||||||||||
|
Données : acide éthanoïque / ion éthanoate pKa = 4,8 ; acide méthanoïque / ion méthanoate pKa = 3,8 ; acide propanoïque/ ion propanoate pKa = 4,9 masse atomique molaire (g/mol) H=1 ; C=12 ; O=16
l'acide chlorhydrique , acide fort correspond au flacon C. Pour les 3 autres flacons, le pH est supérieur à 2 et de plus les 4 solutions ont la même concentration. : les 3 autres acides sont des acides faibles. A concentration identique, l'acide le plus fort a le plus petit pKa et le plus petit pH ( le plus proche de 2 dans ce cas) donc D : acide méthanoïque H-COOH B: acide éthanoïque H3C-COOH et A: H3C-CH2-COOH acide propanoïque On constate que l'acide carboxylique est d'autant plus fort que le squelette carboné compte un plus petit nombre d'atomes de carbone. représentation
de Lewis de l'ion méthanoate :
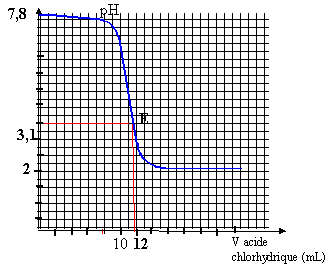
K = [HCOOH] / ([HCOO-][H3O+])= 1 / Ka = 1 / 10-3,8 = 103,8 = 6309. K est assez grand, la réaction est donc totale. A l'équivalence du dosage acide base, les quantités de matière d'acide et de base sont proportionnelles aux coefficients stoéchiomètriques CaVa = Cb Vb Cb = 0,01*12/20 = 6 10-3 mol/L. A l'équivalence la solution contient l'acide faible HCOOH ( majoritaire par rapport à l'ion méthanoate), le pH est donc inférieur à 7 et inférieur au pka du couple acide méthanoïque/ ion méthanoate. pH < 3,8.
retour - menu |