|
sage
femme Ile de
France
2001
|
|||
|
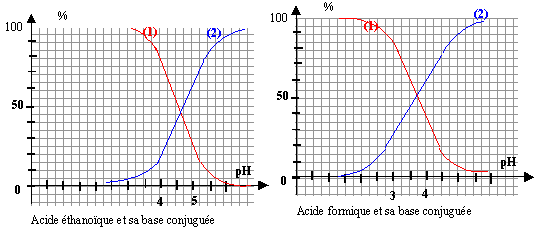
Dans une solution aqueuse de volume final 1L, à 25°C, on mélange : 0,01 mol d'acide acétique ; 0,01 mol d'acide formique et de la soude jusqu'à ce que le pH soit égal à 4.
|
|||
|
HCOOH acide méthanoïque (formique); HCOO- ion méthanoate (formiate) conservation des éléments A1 et A2 : 0,01 = [A1H] +[A1-] (1) 0,01 = [A2H] +[A2-] (2) définition du Ka : 10-4,8 = [A1-][H3O+] / [A1H] = [A1-]10-4 / [A1H] [A1-] / [A1H] =10-0,8 = 0,158 repport dans (1) 0,01 = [A1H] +0,158 [A1H] d'où [A1H] = 0,01 / 1,158 = 8,6 10-3 mol/L et [A1-] = 1,36 10-3 mol/L même calcul avec l'acide formique : 10-3,8 = [A2-][H3O+] / [A2H] = [A2-]10-4 / [A2H] [A2-] / [A2H] =100,2 = 1,58 repport dans (2) 0,01 = [A2H] +1,58 [A2H] d'où [A2H] = 0,01 / 2,58 = 3,9 10-3 mol/L et [A2-] = 6,1 10-3 mol/L sur les graphiques lire les pourcentages correspondants à pH=4 (accord avec les calculs) courbe 1 : pourcentage de l'acide AH et courbe 2 pourcentage de la base conjuguée A-. A1H + HO- donne A1- + H2O K= [A1-] /( [A1H] [HO-] ) = [A1-] [H3O+] /( [A1H] [HO-] [H3O+] ) K = 10-4,8 / 10-14 = 109,2. de même avec l'autre acide on trouve 1010,2. ces réactions acide base sont donc totales. Quantité de matière de soude ayant réagi avec les acides : la solution est électriquement neutre : à pH = 4 l'ion hydroxyde est minoritaire [A1-] +[A2-] = [H3O+] + [Na+] 1,36 10-3 + 6,1 10-3 = 10-4 + [Na+] [Na+] = 1,36 10-3 + 6,1 10-3 - 10-4 = 7,36 10-3 mol /L la quantité de matière d'ion sodium est égale à la quantité de matière de soude ajoutée.
retour - menu |