Comment reconnaître la présence
de certains ions en solution ?
|
nom de l'ion
|
formule
|
test d'identification
|
|
chlorure
|
Cl-
|
donne un solide blanc ( AgCl) qui
noirçit à l'air en présence
d'ion argent Ag+.
|
|
sulfate
|
SO42-
|
donne un solide blanc (
BaSO4) en présence d'ion
baryum Ba2+.
|
|
cuivre (II)
|
Cu2+
|
donne un solide bleu (
Cu(HO)2) en présence d'ion
hydroxyde HO-.
|
|
fer (II)
|
Fe2+
|
donne un solide vert foncé (
Fe(HO)2) en présence d'ion
hydroxyde HO-.
|
|
fer (III)
|
Fe3+
|
donne un solide brun rouille (
Fe(HO)3) en présence d'ion
hydroxyde HO-.
|
|
ion aluminium
|
Al3+
|
donne un solide blanc (
Al(HO)3) en présence d'ion
hydroxyde HO-.
|
|
ion zinc
|
Zn2+
|
donne un solide blanc (
Zn(HO)2) en présence d'ion
hydroxyde HO-.
|
Domaines d'acidité et de basicité en
solution aqueuse.
protocole expérimental afin de distinguer,
à l'aide d'une sonde ou d’un papier pH, les
solutions neutres, acides et basiques.
Déposer une goutte de
solution sur un papier indicateur universel de pH
Puis comparer à la gamme de
couleur pour estimer la valeur du pH.
|
|
Une solution aqueuse
neutre contient autant d’ions hydrogène
H+ que d’ions hydroxyde
HO- : son pH vaut 7 à
25°C.
Dans une solution acide,
il y a plus d’ions hydrogène
H+ que d’ions hydroxyde
HO- : le pH est inférieur
à 7 à 25°C.
Dans une solution basique,
il y a plus d’ions hydroxyde HO-
que d’ions hydrogène
H+ : le pH est supérieur à
7 à 25°C.
Les produits acides ou
basiques concentrés présentent des
dangers : ce sont des liquides
corrosifs.
|
Tests d'identification des ions :
|
|
Réactifs
|
|
Solutions
|
soude, hydroxyde de sodium
|
nitrate d'argent
|
chlorure de baryum
|
|
sulfate de fer II
|
solide vert foncé
|
xxxx
|
solide blanc
|
|
chlorure de fer (III)
|
solide brun rouille
|
précipité blanc
|
xxxx
|
|
sulfate de cuivre
|
solide bleu
|
xxxx
|
solide blanc
|
|
chlorure de cuivre (II)
|
solide bleu
|
solide blanc
|
xxxx
|
|
sulfate de zinc
|
solide blanc
|
xxxx
|
solide blanc
|
|
sulfate d'aluminium
|
solide blanc
|
xxxx
|
solide blanc
|
|
chlorure de zinc
|
solide blanc
|
solide blanc
|
xxxx
|
|
nom de l'ion
|
ion fer II
|
ion fer III
|
ion cuivre II
|
ion zinc
|
ion aluminium
|
|
formule de l'ion
|
Fe2+
|
Fe3+
|
Cu2+
|
Zn2+
|
Al3+
|
|
couleur de la solution
|
vert pâle
|
orangée brune
|
bleu
|
incolore
|
incolore
|
|
couleur du précipité
après ajout de soude
|
vert foncé
|
brun rouille
|
bleu
|
blanc
|
blanc
|
Réaction entre le fer et l’acide
chlorhydrique ; quels produits sont
formés ?
Les ions hydrogène et chlorure sont
présents dans une solution d’acide
chlorhydrique.
Le fer réagit avec l’acide chlorhydrique,
avec formation de dihydrogène et d’ions fer
(II).
Critères de reconnaissance d'une transformation
chimique :
disparition partielle ou totale des réactifs et
apparition de produits.
Reconnaître la présence des ions
chlorure et des ions hydrogène ;
ion chlorure : donne un solide blanc qui noirçit
à la lumière en présence d'ion argent
Ag+.
ion hydrogène : le pH de la solution est
inférieur à 7.
|
|
Pile électrochimique et
énergie chimique.
Comment une pile électrochimique
peut-elle être une source
d’énergie ?
La pile est un réservoir
d’énergie chimique. La pile est
constituée d'un ensemble de produits
chimiques
Lorsque la pile fonctionne, une partie de cette
énergie est transférée sous
d’autres formes :
- énergie électrique
- énergie thermique ( chaleur)
L'énergie mise en jeu dans une pile
provient d'une réaction chimique : la
consommation de réactifs entraîne
l'usure de la pile.
Réaliser,
décrire et schématiser la
réaction entre une solution aqueuse de
sulfate de cuivre et de la poudre de
zinc :
- par contact direct
;
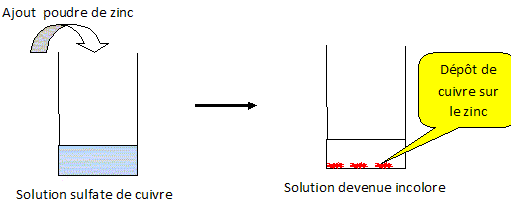
- en réalisant une
pile.
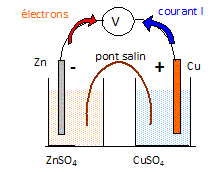
Le pont salin est un
simple papier buvard imprégné d'eau
salée.
|

