|
Synthèses d'espèces chimiques |
|||||||
|
|||||||
|
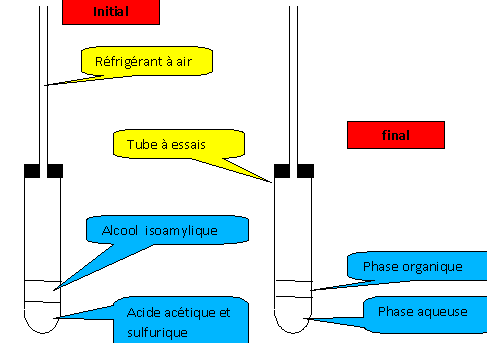
Il est possible de réaliser la synthèse d’espèces chimiques déjà existantes dans la nature. Buts : suivre le protocole de la synthèse, effectuée de manière élémentaire, de l'acétate d'isoamyle. Identifier les risques correspondants, respecter les règles de sécurité Étape 1 : dans un tube à essais verser : un volume V1 = 2 mL d'alcool isoamylique, prélever l'aide d'une pipette. un volume V2 = 2 mL d'acide acétique (acide éthanoïque), prélever l'aide d'une pipette. quelques gouttes d'acide sulfurique concentré ( cet acide n'est pas un réactif : il permet à la réaction se produise plus rapidement ). Le tube est fermé avec un bouchon équipé d'un tube en verre. La tige de verre joue le rôle de " réfrigérant à air ". Le tube à essais est placé au bain marie pendant 15 minutes. alcool isoamylique : nocif, infalmmable Il faut donc travailler en l'absence de flamme et dans un local aéré. corrosif : éviter tout contact, port de
blouse, gants et lunette de protection L'acide sulfurique concentré
réagit violemment avec l'eau. Les vapeurs se condensent dans le réfrigérant à air et tombent à l'état liquide dans le tube à essais. L'alcool isoamylique et l'acide acétique sont des liquides non miscibles. Le liquide le plus dense, les acides, ocuppe la partie inférieure. Après transformation chimique, la substance odorante ( phase organique) et la phase aqueuse ne sont pas miscibles. Le liquide le plus dense, la phase aqueuse, ocuppe la partie inférieure.
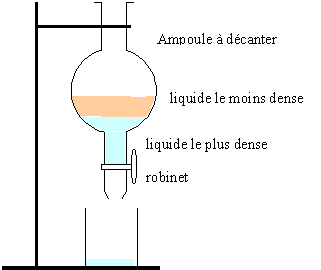
Étape 2 : Ajouter à de l'eau salée la solution obtenue dans le tube à essais. Les différentes parties du mélange sont séparer à l'aide d'une ampoule à décanter. Le produit obtenu, " acétate d'isoamyle " est moins soluble dans l'eau salée que dans l'eau. Cette opération à pour but de mieux séparer le produit obtenu de la phase aqueuse.
Comment appelle-t-on ce montage ? Quel est son rôle ? Quelle méthode de chauffage doit-on utiliser ? Le chauffage à reflux accélère une réaction lente, sans perte de matière. On utilise un chauffage électrique + bain marie. L'acide sulfurique que l'on ajoute est-il un réactif ? L'acide sulfurique est un catalyseur : ce n'est pas un réactif. Quels ont les reactifs et les produits formés? Ecrire le bilan de cette transformation chimique. réactifs : acide butanoïque et éthanol produits : butanoate d'éthyle et eau acide butanoïque + éthanol = butanoate d'éthyle + eau CH3-CH2-CH2-COOH + CH3-CH2OH = CH3-CH2-CH2-COO-CH2-CH3 + H2O C4H8O2 + C2H6O = C6H12O2 + H2O Déterminer le nom et le nombre des atomes qui composent le butanoate d'éthyle. 6 atomes de carbone ; 12 atomes d'hydrogène et 2 atomes d'oxygène.
|
|||||||
|
|