|
Exercices Chimie 4ème |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Une chambre mesure 5,0 mètres de long sur 4,0 mètres de large et 2,5 mètres de haut. Les objets placés dans la chambre occupent 8,0 % du volume total, quel est le volume ( m3 et litres) d'air dans la pièce. Volume de la pièce ( m3) = largeur(m) * longueur (m) * hauteur (m) V = 4*5*2,5 = 50 m3 ; Volume des meubles et objets : 0,080*50 = 4,0 m3 ; Volume d'air : 50-4,0 = 46 m3 1 m3 = 1000 L ; V = 4,6 104 L. Quelle est la composition en volume de l'air ? 20 % de dioxygène et environ 80 % de diazote. Quel est le volume de dioxygène dans cette pièce ? 46 * 0,20 =9,2 m3. Comment mettre en évidence le dioxygène ? Une allumette rougie s'enflamme dans le dioxygène. Les dimensions d'une
pièce d'habitation sont : longueur 4,0 m ;
largeur 3,0 m et hauteur 2,5 m. Calculer le volume de
dioxygène contenu dans a
pièce. Volume de la pièce
: 4,0*3,0*2,5 = 30
m3. L'air contient en volume
environ 20 % de dioxygène soit : 30*0,2 =
6,0
m3. Un chauffage
à gaz consomme l'équivalent de 10
dm3 de dioxygène à la
minute.
En combien de temps
tout le dioxygène de la pièce
sera-t-il consommé
?
Conclure. 6,0 m3 = 6,0
103 dm3. 6,0 103 / 10 =
6,0 102 minutes soit environ
10
heures. Il faut donc aérer
les pièces où l'on vit , surtout
quand des appareils de chauffage à gaz y
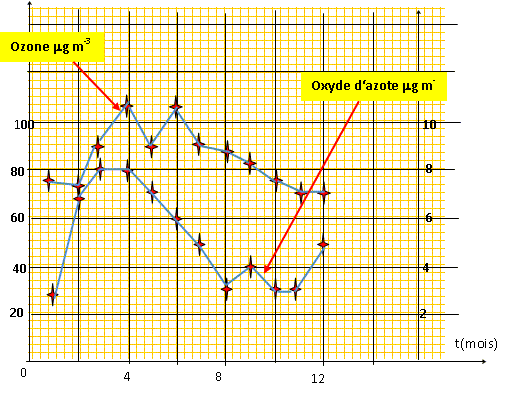
fonctionnent . On donne les moyennes mensuelles de
l'ozone et des oxydes d'azote au sommet de la station du
Puy-de Dôme. mg
m-3 Tracez les deux courbes sur le même graphique en plaçant les mois sur l'axe des abscisses et la concentration en ozone et oxydes d'azote sur l'axe des ordonnées.
Masse d'air : Un pneu de voiture contient 30 L d'air. Calculez la masse d'air qu'il contient à la pression et à la température du pneu. ( 1 L d'air à une masse de 2,6 g dans ces conditions de température et de pression) 2,6*30 = 78 g. Quelle est la masse d'un litre d'air dans les conditions normales de température et de pression ? 1,3 g . Quelles différences y a-t-il au niveau des molécules dans l'atmosphère et dans le pneu ? Dans le pneu les chocs entre les molécules d'air et l'enveloppe du pneu sont beaucoup plus importants. La pression de l'air dans le pneu est supérieure à la pression normale.
Voici les principales sources de rejets annuels de gaz à effet de serre en France. Transforme les données en pourcentages et complète alors le tableau. ( résultats en rouge sur fond jaune ).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|