|
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
Dans 1 L d'eau pure on introduit 7,624 g de chlorure de magnésium, 6,666 g de chlorure de calcium, 6,344 g de chlorure de strontium et 4,166 g de chlorure de baryum. La solution n'est pas saturée. On donne : Mg= 24,3 ; Ca= 40,1 ; SR= 87,6 ; Ba= 137,3 ;
Cl = 35,5 g/mol Diagramme théorique de distribution des espèces :
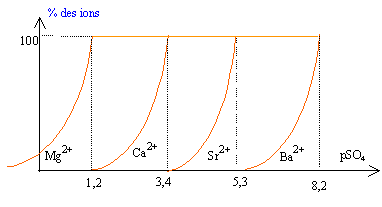
corrigé |
||||||||||||||||||||||||||||||||||||||||
|
Le produit de solubilité s'écrit : Ks = [X2+] [SO42- ] ou encore log Ks = log [X2+] + log[SO42- ] -pKs = log [X2+] -pSO4. pKs = -log [X2+] + pSO4.
soit dans l'ordre BaSO4 ;
SrSO4 ; CaSO4 ; MgSO4
Au début de la précipitation du sulfate de baryum [SO42- ] = 10-8,2 = 6,3 10-9 mol/L on a alors verdé v1 L de solution d'acide sulfurique [SO42- ] = Qté matière (mol) / volume total solution (L) = 1*v1 / (1+v1) 6,3 10-9(1+v1)=
v1d'où v1 =
6,3 10-9 L ,
précipitation immédiate.
[SO42- ] [Ba2+]= 1,26 10-10 donne [SO42- ] = 1,26 10-10 / [Ba2+] et [SO42- ] [Sr2+]= 2 10-7donne [SO42- ] = 2 10-7 / [Sr2+] soit 1,26 10-10[Sr2+] = 2 10-7[Ba2+] [Sr2+] = 1587 [Ba2+] on a ajouté v2 L d'acide sulfurique : [Sr2+] =0,04 / (1+v2) et [Ba2+] = (0,02-v2)/ (1+v2) 0,04 = 1587 (0,02-v2) d'où
v2 = 0,02
L.
[SO42- ] [Ca2+]= 2,4 10-5 donne [SO42- ] = 2,4 10-5 / [Ca2+] et [SO42- ] [Sr2+]= 2 10-7donne [SO42- ] = 2 10-7 / [Sr2+] soit 2,4 10-5 [Sr2+] = 2 10-7[Ca2+] [Ca2+] = 120 [Sr2+] on a ajouté v3 L d'acide sulfurique : Qté de matière (mol) d'ion Sr2+ ayant précipité : (v3-v2 )1 mol [Ca2+] =0,06 / (1+v3) et [Sr2+] = (0,04-(v3-v2 ))/ (1+v3) 0,06 = 120 (0,04-(v3-v2 ))
d'où v3 -v2 =
39,5 mL et v3 =
59,5 mL.
[SO42- ] [Ca2+]= 2,4 10-5 donne [SO42- ] = 2,4 10-5 / [Ca2+] et [SO42- ] [Mg2+]= 5 10-3donne [SO42- ] = 5 10-3 / [Mg2+] soit 2,4 10-5 [Mg2+] = 5 10-3[Ca2+] [Mg2+] = 208 [Ca2+] on a ajouté v4 L d'acide sulfurique : Qté de matière (mol) d'ion Ca2+ ayant précipité : (v4-v3 )1 mol [Mg2+] =0,08 / (1+v4) et [Ca2+] = (0,06-(v4-v3 ))/ (1+v4) 0,08 = 208 (0,06-(v4-v3 ))
d'où v4 -v3 =
59,6 mL et v4 =
119,1 mL.
Au début de la précipitation du sulfate de strontium [SO42- ] = 10-5,3 = 5 10-6 mol/L [SO42- ] [Ba2+]= 1,26 10-10 donne [Ba2+] =1,26 10-10 / 5 10-6 = 2,52 10-5 mol/L. négligeable. Lorsque les différents précipités apparaissent les ions en solution correspondant aux précipités restent ultra minoritaires. On peut donc faire une séparation par précipitation ; on élimine les précipités successifs par filtration
retour - menu |
||||||||||||||||||||||||||||||||||||||||