|
|
||
|
||
|
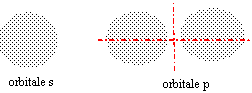
L'électron n'est pas localisé mais on peut représenter des régions de l'espace où cet électron a une forte probabilité de se trouver :c'est l'orbitale atomique. L'orbitale s est sphérique (l = 0), L'orbitale p (l = 1) est formée de 2 lobes centrés sur un axe commun. Il y a 3 orbitales p (m = -1, 0, +1), px suivant l'axe des x, py suivant l'axe des y et pz suivant l'axe des z,
La forme des 5 orbitales d (l = 2) est plus complexe (m = -2, -1, 0, 1, 2): Trois orbitales d comportent 4 lobes dans les plans bissecteurs des quadrants : (dxy, dxz, dyz). Les deux autres orbitales d sont centrées sur les axes : dx2-y2 suivant les axes x et y, dz2 a 2 lobes
centrés sur l'axe z et possède un petit volume
torique dans le plan xOy.
exemple :donner la structure de V(Z=23) * Considérer le nombre d'électrons de l'atome : 23 * On remplit successivement toutes les OA : 2 électrons pour s ; 6 électrons pour p ; 2 dans l'O.A 1s ; 2 dans l'O.A 2s ; 6 dans l'O.A 2p ; 2 dans l'O.A 3s ; 6 dans l'O.A 3p ; il reste 5 électrons à placer : 2 dans l'O.A 4s et 3 dans l'OA 3d soit 1s² 2s² 2p6 3s² 3p6 4s² 3d3. anomalie
:
quand on est près de la moitié ou du
remplissage total de d, un électron de s se
déplace : pour le chrome (Z=24) on a :1s²
2s² 2p6 3s² 3p6
4s1
3d5.
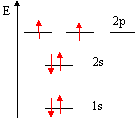
configuration : 1s² 2s² 2p2
|
||
|
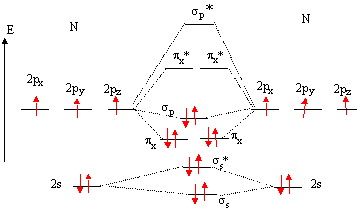
Les 3 hypothèses fondamentales :
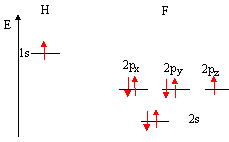
Bien souvent , il suffit de savoir tracer le diagramme correspondant, et non pas de faire le calcul des OM. * placer les OA des deux atomes de part et d'autre d'un espace destiné au tracé des OM. Remarquons que le nombre d'OM est égal au nombre d'OA. Si deux atomes ne sont pas identiques, les OA n'ont pas la même énergie : l'atome le plus électronégatif est celui dont les OA sont situées le plus bas. H : 1 électron sur la couche externe ; F : 7 électrons sur la couche externe.
* connaître les liaisons :
* trouver les positions des OM par rapport aux OA :
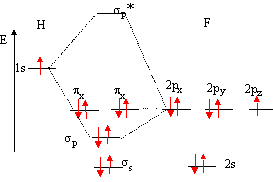
la 2s de F trop éloignée en énergie de la 1s de H ne peut interagir avec celle-ci et reste au même niveau étude de l'indice de liaison : cet indice est défini de la manière suivante : i = 1(n-n*) n : nombre d'électrons dans les orbitales liantes n* nombre d'électrons dans les orbitales non liantes plus cet indice est grand, plus l'énergie de la liaison augmente et plus sa longueur diminue. pour HF : i
=½ 2-0) = 1 ; on a une liaison covalente simple
(liaison
s)et
trois doublets non liants autour de F
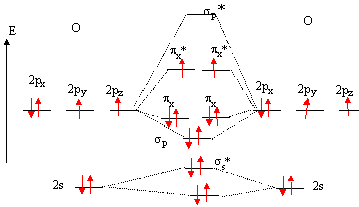
OM de N2 :
retour - menu |