[Hg(NH3)2]2+
: ion diammine mercure II
[Hg(NH3)3]2+ :
ion triamminemercure III
écrire les deux réactions de complexations
:
Hg2+ + 2NH3 équilibre avec
[Hg(NH3)2]2+ ;
b2 =
1018
Hg2+ + 2NH3 équilibre avec
[Hg(NH3)2]2+ ;
b3 =
1020
le complexe est d'autant plus stable que sa constante de
formation est grande ; la seconde réaction est
prépondérente et
quasi-quantitative
|
|
Hg2+
|
+ 3
NH3
|
[Hg(NH3)2]2+
|
|
état initial
|
0,01 mol
|
1 mol
|
0
|
|
en cours
|
0,01-x
|
1- 3
x
|
x
|
|
état final
|
0
|
0,97
|
0,01
|
avancement maximal : xmax=0,01 mol
L'ammoniac est une base faible peu dissociée sous
cette concentration : [NH4+]
voisin de zéro.
conservation de
l'élément mercure :
0,01 = [Hg2+] +
[[Hg(NH3)2]2+]
+[
[Hg(NH3)3]2+]
(1)
constante de formation des
complexes :
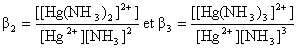
dans (1) mettre
[Hg2+] en facteur commun
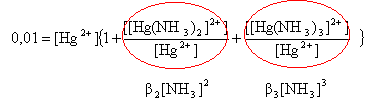
remplacer [NH3] par 0,97 et
b2 par 1018
et b3 par
1020.
0,01 = [Hg2+] ( 1 + 9,4
1017 +9,1 1019 ) d'où
[Hg2+] = 1,08
10-22 mol/L
à partir de l'expression de b2
:
[[Hg(NH3)2]2+]=1018*1,08
10-22*0,97² =
1,02
10-4
mol/L
à partir de l'expression de b3
:
[[Hg(NH3)3]2+]=1020*1,08
10-22*0,973 =
9,90
10-3 mol/L
pH=
7,2 :
pH d'une solution d'acide ou de
base faible :
pH = pKa + log
[NH3]/[NH4+]
d'où :
[NH3]/[NH4+]
= 7,2-9,2 = 0,01
[NH3] = 0,01
[NH4+].(3)
conservation de
l'élément azote :
1 = [NH3] +
[NH4+] + 2
[[Hg(NH3)2]2+]
+ 3[
[Hg(NH3)3]2+]
(2)
or
[Hg2+]initial =0,01
mol/L
[[Hg(NH3)2]2+]
et [
[Hg(NH3)3]2+]
sont au plus égaux à 0,01 mol/L
(2) s'écrit : 1
voisin de [NH3] +
[NH4+]
compte tenu de (3) :
[NH4+]
voisin
1
mol/L
;
[NH3] voisin
0,01 mol/L.
faire le rapport :
b3
/b2
:
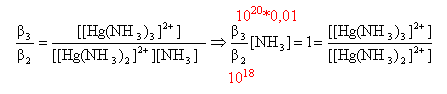
[[Hg(NH3)2]2+]
= [
[Hg(NH3)3]2+]
conservation de
l'élément mercure : voir ci
dessus
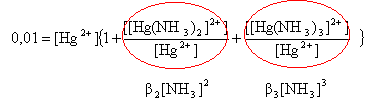
remplacer [NH3] par 0,01 et
b2 par 1018
et b3 par
1020.
0,01 = [Hg2+] ( 1 +1014 +
1014 ) d'où [Hg2+] =
5 10-17
mol/L
à partir de l'expression de b2
:
[[Hg(NH3)2]2+]=1018*5
10-17*10-4 =
5
10-3
mol/L