|
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
Un tel système est constitué d'atomes dont les oprbitales p se recouvrent latéralement. Cela nécessite que les atomes soient coplanaires. En dehors d'une suite ininterrompues de double liaison >C=C< il faut ausi penser aux hétéroatomes.
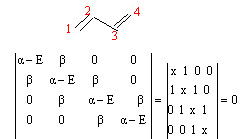
simplifier le déterminant séculaire : ( système C et H ) les simplifications :
exemple du
butadiéne :
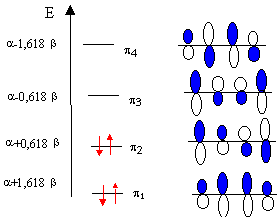
soit x1 = 1,618 ; x2 = 0,618 ;x3 = -0,618 ; x4 = -1,618 ; quant aux énergies des OM : E1 = a+1,618 b ; E2 = a +0,618 b ; E3 =a -0,618 b ; E4 = a -1,618 b; déterminer les coefficients des OM : pour x= -1,618 résoudre le système d'équations suivant : -1,618 c1 + c2 = 0 (1) donne c2 =1,618 c1 ( repport dans (2)) c1-1,618c2+c3=0 (2) donne c3 = 1,618 c1 (repport dans(4)) c2-1,618c3+c4=0 (3) c3-1,618 c4=0 (4) donne c1=c4 condition de normation c1²+c2²+c3²+c4²=1 mêmes calculs pour les autres valeurs de x. exploiter les résultats : la première colonne du
tableau donne les énergies des OM (
b
<0)
et les colonnes suivantes donnent la part de chaque OA dans
l'OM. On colorie par exemple le lobe inférieur quand le coefficient est négatif. et le lobe supérieur si le coefficient est positif
calcul de l'énergie de résonance : c'est la différence d'énergie d'un système (hypothétique ) de doubles liaisons isolées d'énergie 2(a+b) ( énergie d'une double liaison à deux électrons) et l'énergie électronique du système conjugué en kJ/mol Erésonance = 4(a+b) - 2 (a+1,618b)-2(a+0,618b) = -0,472 b (valeur positive car b <0) calcul de l'indice de liaison : il représente la force de la liaison entre deux atomes noté j et k pjk=Si ni Cij Cik. p12 = p34 = 2(0,372*0,602)+2(0,602*0,372)= 0,896. p23 =2(0,602*0,602)+2(0,372-(-0,372))= 0,448 calcul de l'a charge électronique totale d'une molécule qj=Si ni Cij2. q1 =q2 =
q3 = q4 = 2*0,602²+2 0,372²
= 1
|
|||||||||||||||||||||||||
|
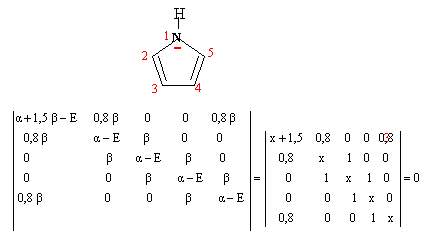
on remplace a par a+kb et b par hb h et k dépendent de l'héteroatome et valent k=1,5 et h=0,8 pour un atome d'azote.
retour - menu |