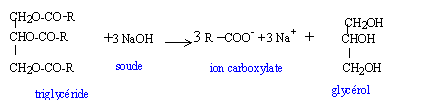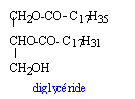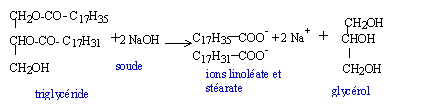|
|
||
|
||
|
Détermination de la formule moléculaire d'un triglycéride homogène et pur :
alpha linolénate, béta stéarate de glycérol (acide linoléïque M=280 g/mol ; C17H31-COOH ; acide stéarique M=284 g/mol ; C17H35-COOH corrigé |
||
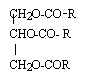
la masse molaire est égale à : 3 masse molaire de R + ( 6*12+5+6*16) M = 3MR + 173. indice de saponification : masse de potasse (mg) KOH nécessaire pour saponifier 1g de ce triglycéride.
0,190 g de potasse soit 0,190 / masse molaire de la potasse 56 = 3,4 10-3 mol de potasse or 1 mol de triglycéride est saponifiée par 3 moles de potasse (équation ci dessus) donc 3,4 10-3 /3 = 1,13 10-3 mol de triglycéride 1,13 10-3 mol correspondent à 1 g masse molaire du triglycéride : 1 /1,13 10-3 = 884 g/mol . MR = (884 -173) /3 = 237 g/mol masse molaire de l'acide carboxylique R-COOH : 237 + 45 = 282 g/mol. si R posséde une liaison double C=C alors R s'écrit CnH2n-1. 237 = 12 n + 2n-1 soit n = 17. C17H33COOH : acide oléïque
Indice d'acide : c'est le nombre de mg de KOH nécessaire pour neutraliser les acides libres contenus dans 1 g de l'échantillon. dans ce diglycéride il n'y a pas de fonction acide libre : IA = 0. Indice de saponification : c'est le nombre de mg de KOH nécessaire pour saponifier 1 g du composé.
masse molaire du diglycéride : 12*39+72+16*5 =620 g/mol 1/620 = 1,62 10-3 mol diglycéride donc 2*1,62 10-3 = 3,24 10-3 mol de potasse masse de potasse : 56 *3,24 10-3 = 0,18 g =180 mg indice de saponification : IS = 180. Indice d'ester : c'est la différence entre l'indice de saponification et l'indice d'acide. soit IE = 180. Indice d'iode : masse d'iode additionnée par 100 g de produit, acides ou alcools gras des graisses, cires et huiles. le diiode s'additionne sur les liaisons doubles C=C ; or la chaine carbonée de l'acide linoéïque compte deux liaisons C=C ; celle de l'acide stéarique ne compte pas de liaison C=C. une mole de ce diglycéride additionne deux moles d'iode. 100/620 = 0,161 mol diglycéride soit 2*0,161 = 0,322 mol d'iode masse molaire I2 = 2*127 = 254 g/mol masse d'iode : 254*0,322 = 82 g indice d'iode : II =82.
retour - menu |