|
Réactions totales ? autour de l'ammoniac bac S Amérique du Nord 2008. voir le site du lycée Rochambeau |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La synthèse industrielle de l'ammoniac s'effectue en phase gazeuse. Les réactifs dihydrogène et diazote sont introduits en proportions stoechiométriques. La réaction a lieu en présence d'un catalyseur qui est du ruthénium sur un support de graphite, sous une pression comprise entre 100 Bar et 200 bar et à une température comprise entre 350°C et 500 °C. ( d'après http://www.iupac.org ) L'équation associée à la réaction de synthèse est N2(g) + 3H2(g) = 2NH3(g). Dans un réacteur, on mélange 100 mol de diazote et 300 mol de dihydrogène. Le taux d'avancement final est t = 0,70. Donner l'expression du taux d'avancement final et la signification des termes utilisés. t = xfin / xmax ; xfin avancement final (mol) et xmax avancement maximal (mol). La réaction de synthèse de l'ammoniac est-elle une réaction totale ? Justifier. Le taux d'avancement final est inférieur à 1 : la réaction est limité, elle n'est pas totale. Etablir le tableau d'avancement relatif à cette réaction. En déduire la composition finale en quantité de matière du mélange.
Le nombre de chocs efficaces entre
molécules est plus important : la vitesse de
la réaction augmente. Quel est le rôle
du catalyseur dans la synthèse de
l'ammoniac ? Accélère la réaction :
l'équilibre est plus rapidement atteint ; sa
composition n'est pas modifiée.
Donner l'expression de la constante d'équilibre associée à l'équation (1) et déterminer sa valeur. K = [HO-aq][NH4+aq] / [NH3 aq].
K =(t n0)2 / (n0(1-t )) = n0t2/ (1-t ) = 0,01*0,042/(1-0,04) =1,67 10-5 ~ 1,7 10-5. En déduire la constante d'acidité Ka du couple NH4+aq / NH3 aq. Or la constante d'acidité du couple NH4+aq / NH3 aq s'écrit : Ka = [NH3 aq] [H3O+ aq] / [NH4+aq] soit : [NH4+aq] / [NH3 aq] = [H3O+ aq] /Ka . Repport dans l'expression de K : K = [HO-aq][H3O+ aq] /Ka . K= Ke/Ka d'où
Ka =Ke/ K =
10-14/1,67 10-5
=6,1 10-10.
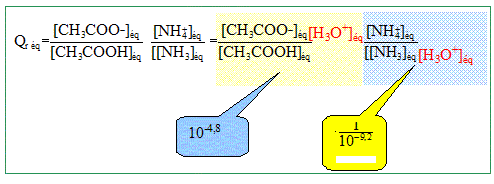
pKa ( NH4+/NH3)= 9,2 ; pKa ( CH3COOH/CH3COO-) =4,8. Expérience : Etat initial : dans un becher on introduit VA= 100,0 mL d'une solution d'acide éthanoïque de concentration cA= 0,10 mol/L et VB = 40,0 mL d'une solution aqueuse d'ammoniac de concentration cB=0,50 mol/L. Dans cet état on néglige la présence d'ion CH3COO- et NH4+. Etat d'équilibre : le pH du mélange est mesuré est vaut pH= 9,2. La transformation chimique qui a lieu est modélisée par la réaction chimique d'équation CH3COOH aq+NH3 aq = CH3COO- aq + NH4+ aq ( (2) Donner l'expression littérale puis calculer le quotient de réaction du système Qr éq dans l'état d'équilibre.
Qr éq = 10-4,8 +9,2 = 104,4 = 2,5 104. Quel est la valeur du quotient Qr i de réaction dans l'état initial ? Le comparer à Qr éq et conclure sur l'évolution du système. Qr i =[CH3COO- ]i [NH4+]i /([CH3COOH]i [NH3]i ). Or [NH4+]i ~[CH3COO- ]i~ 0 ; en conséquence Qr i ~0. Le quotient initial étant inférieure à Qr éq, le système évolue spontanément dans le sens direct.
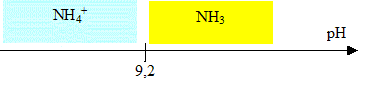
Pour le couple NH4+ /NH3, tracer le diagramme de prédominance des espèces en fonction du pH.
En déduire la relation entre [NH3]éq et [NH4+]éq dans le mélange étudié. Le pH du mélange est mesuré est vaut pH=pKa(NH4+ /NH3)= 9,2, donc [NH3]éq = [NH4+]éq Donner, en le justifiant, la relation entre [NH4+]éq et [CH3COO- ]éq.
La mesure de la conductivité de la solution S a permis de connaître la concentration en ion ammonium à l'équilibre. Sa valeur est 7,1 10-2 mol/L. En déduire la quantité de matière des espèces NH4+, CH3COO-, NH3 et CH3COOH présentes dans le mélange à l'équilibre. [NH4+]éq =7,1 10-2 mol/L ; volume de la solution 0,14 L xfin = n(NH4+) = 7,1 10-2*0,14 =9,94 10-3 ~9,9 10-3 mol. n(CH3COO-) = n(NH4+) =n(NH3) = ~9,9 10-3 mol. n(CH3COOH ) =0,01- xfin =0,01-9,94 10-3 ~6,0 10-5 mol. La transformation chimique entre l'acide éthanoïque et l'ammoniac modélisée par la réaction chimique d'équation (2) est-elle totale ? t = xfin /xmax = 9,94 10-3 /0,01 = 0,994, valeur très proche de 1 : la transformation peut être considérée comme totale.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|