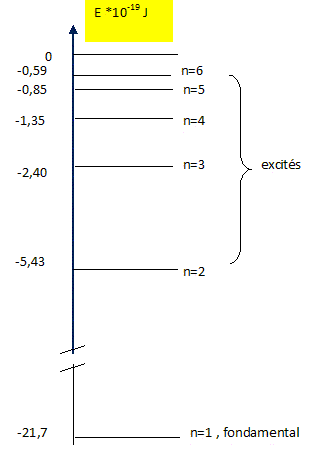|
atome d'hydrogène: séries de Lyman et Balmer d'après IMRT |
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
|
Par convention, l'énergie de l'atome est nulle lorsque l'électron et le proton sont infiniment éloignés l'un de l'autre ( ionisation). On donne les longueurs d'onde de la série de Lyman :
Calculer en joule l'énergie des niveaux 2, 3, 4, 5 et 6 de l'atome d(hydrogène . Energie du photon = En-E0 = hc / l. avec E0 = -13,6 *1,6 10-19 = -2,176 10-18 J E2-E0 = 6,62 10-34 * 3 108 / 121,6 10-9=1,633 10-18 J E2= E0 +1,633 10-18 = ( -2,176 +1,633) 10-18 ; E2= - 5,43 10-19 J. E3= E0 +1,936
10-18 = ( -2,176 +1,936)
10-18 ;
E3=
- 2,40
10-19
J.
E4= E0 +2,041
10-18 = ( -2,176 +2,041)
10-18 ;
E4= -
1,35 10-19
J.
E5= E0 +2,091
10-18 = ( -2,176 +2,0917)
10-18 ;
E5= -
0,85 10-19
J.
E6= E0 +2,117 10-18 = ( -2,176 +2,117) 10-18 ; E6= - 0,59 10-19 J.
En = E0 / n2 avec n : nombre quantique principal.
|
||||||||||||||||||||||||||||||||||
|
|