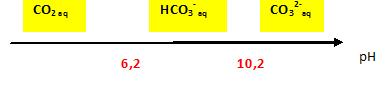|
Aspects physico-chimiques de la formation des cavités souterraines : concours général 2005 |
|||||||
|
|||||||
|
Le calcaire, légèrement soluble dans l’eau pure, l’est beaucoup plus si l’acidité de la solution augmente. D’autre part l’acidité de l’eau dans ce type de milieu naturel dépend largement de la teneur en dioxyde de carbone CO2 dissous. Pour comprendre le mécanisme de formation des cavités, nous allons étudier les échanges de matière en CO2 à l’interface eau - atmosphère puis ceux en ions Ca2+ et CO32- à l’interface eau - roche. Echanges de dioxyde de carbone à l’interface eau-atmosphère. On considère l’équation de la réaction chimique [0] entre le dioxyde de carbone présent dans l’atmosphère sous forme gazeuse : CO2(gaz) et le dioxyde de carbone dissous en solution aqueuse CO2(aq). CO2 (gaz) = CO2(aq) [0] Lorsque le système décrit par la réaction [0] est à l’équilibre, la concentration, exprimée en mol.L-1, en CO2(aq) : [CO2(aq) ] est reliée à la pression partielle, exprimée en bar, en CO2(gaz) : PCO2(gaz) par la relation : [CO2(aq) ] =K0PCO2(gaz) avec K0 =3,2 10-2. Actuellement la pression partielle moyenne en CO2(gaz) dans l’atmosphère est évaluée à 3.10-4 bar. Cette valeur est très faible par rapport à la pression atmosphérique ( de l'ordre de 1 bar ) et par rapport aux pressions partielles en O2(g) ( 0,2 bar) et N2(g) (0,8 bar). La pression partielle de CO2(gaz) dans l’atmosphère a augmenté au cours des dernières décennies du fait de la combustion de grandes quantités de combustibles fossiles. Concentration en CO2(aq) dans une solution aqueuse initialement pure en équilibre avec cette atmosphère. [CO2(aq) ] =K0PCO2(gaz) = 3,2 10-2* 3.10-4 = 9,6 10-6 mol/L. CO2(aq) + 2H2O =
HCO3-(aq) +
H3O+(aq) (1) constante d'acidité Ka1 =
[HCO3-(aq)][H3O+(aq)]
/[CO2(aq)] HCO3-(aq) +H2O
= CO32-(aq) +
H3O+(aq) (2) constante d'acidité Ka2 =
[CO32-(aq)][H3O+(aq)]
/[HCO3-(aq)] Rappeler la
définition d’un acide. Espèce, ion ou molécule
susceptible de céder un proton
H+. Diagramme de prédominance des espèces :
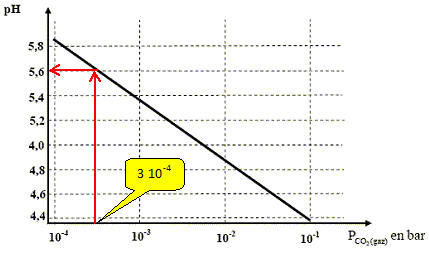
Une eau initialement pure est en équilibre avec une atmosphère qui contient du dioxyde de carbone à la pression partielle de 3.10-4 bar. Le pH de la solution obtenue vaut 5,6. En déduire les concentrations à l’équilibre de tous les ions présents dans la solution. [H3O+]= 10-5,6 = 2,5 10-6 mol/L ; [HO-] =10-14 / [H3O+]=10-14 /(2,5 10-6)=4,0 10-9 mol/L ; à pH=5,2, CO2(aq) et HCO3-(aq) sont majoritaires ; le couple acide / base CO2(aq) / HCO3-(aq) fixe le pH. 5,6 = pKa1 + log ([HCO3-(aq)] /[CO2(aq)]) ; log ([HCO3-(aq)] /[CO2(aq)]) =5,6-6,2 =-0,6 [HCO3-(aq)] /[CO2(aq)] =0,25 ; Or [CO2(aq) ] =K0PCO2(gaz) = 3,2 10-2* 3.10-4 = 9,6 10-6 mol/L. [HCO3-(aq)] = 0,25 *9,6 10-6 =2,4 10-6 mol/L. Puis Ka2 = [CO32-(aq)][H3O+(aq)] /[HCO3-(aq)] donne : [CO32-(aq)] =Ka2[HCO3-(aq)] / [H3O+(aq)]. [CO32-(aq)] =10-10,2 *2,4 10-6 /10-5,6 =6,0 10-11 mol/L. Dans les sols, la pression partielle en CO2(gaz) peut être très supérieure et atteindre 0,1 bar. Ces fortes teneurs résultent de l’activité des plantes, des microorganismes du sol et surtout de la décomposition de la matière organique. Ainsi l’eau qui « percole » dans le sol s’enrichit en CO2(aq). La courbe ci-dessous donne le pH d’une solution aqueuse initialement pure en équilibre avec une atmosphère contenant du dioxyde de carbone, en fonction de la pression partielle en CO2(gaz) : On peut remarquer que suivant l’axe horizontal, on a utilisé une échelle logarithmique. En expliquant la méthode utilisée, retrouver graphiquement la valeur du pH à l’équilibre pour une pression partielle en CO2(gaz) égale à 3.10-4 bar. log 3 = 0,47
Décrire l’évolution, en fonction de la profondeur, de l’acidité de l’eau qui « percole » dans ce type de sols. La pression du dioxyde de carbone augmente avec la profondeur, donc le pH de l'eau va diminuer et l'acidité augmente.
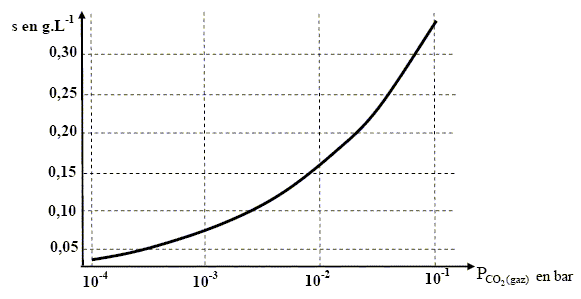
Pour modéliser la dissolution de la roche calcaire essentiellement constituée par de la calcite ou carbonate de magnésium CaCO3(s) , il convient d’ajouter aux trois réactions chimiques précédentes une dernière [3] associée à la dissolution de la calcite : CaCO3(s) = Ca2+(aq) + CO32-(aq) [3] Les réactions chimiques [0] , [1], [2] et [3] forment un « système couplé » complexe qui permet de rendre compte de manière satisfaisante du processus de dissolution des roches calcaires. Lorsque le système chimique [3] est à l’équilibre, la solution est dite saturée. La solubilité s du carbonate de calcium est la masse maximale que l’on peut dissoudre par litre d’eau ; elle s’exprime en g.L-1. La figure ci-dessous représente la solubilité s du carbonate de magnésium en fonction de la pression partielle en CO2(gaz) : PCO2(gaz) . Suivant l’axe horizontal, on a utilisé une échelle logarithmique.
Dissolution de CaCO3(s) . La solubilité de la calcite croît avec la pression partielle en CO2(gaz). L’eau de pluie au contact des des sols s’enrichit en CO2(aq) et son acidité augmente. La solubilité de la calcite augmente avec la teneur en CO2(aq). L’eau est ainsi de plus en plus agressive au cours de sa descente dans le sol : d'où l’érosion des roches par dissolution. Enfin l’érosion mécanique joue un rôle primordial dans les endroits où la vitesse d'écoulement des eaux est grande. Formations de concrétions. On observe fréquemment dans les cavités et grottes des régions calcaires des concrétions de formes diverses : comme les stalactites et les stalagmites. Les eaux de ruissellement, saturées en carbonate de calcium et très riches en CO2(aq) après un trajet « sous pression » dans les fractures du massif calcaire, s’écoulent en goutte à goutte de la voûte d’une cavité et restituent alors au milieu une partie du carbonate de calcium dissous. Au niveau de la voûte d’une cavité, les eaux saturées en carbonate de calcium, très riches en CO2(aq) entrent au contact de atmosphère de la cavité contenant peu de CO2(g). La courbe ci-dessus indique que la solubilité de la calcite diminue, ce qui se traduit par une précipitation de l’excès de carbonate de calcium.
|
|||||||
|
|