|
acide base ; oxydoréduction ( concours manipulateur radio AP HP 2009) |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Exercice 1 : On dissout du chlorure d'hydrogène dans l'eau pure. Quels sont les ions présents en solution ? oxonium H3O+aq et chlorure Cl-aq. Donner la relation de définition du pH. pH = - log [H3O+aq ] avec [H3O+aq ] exprimée en mol/L. On dissout 48 L de chlorure d'hydrogène dans 1 m3 d'eau. Si l'on considère la réaction entre le chlorure d'hydrogène et l'eau comme totale, quel est le pH de la solution obtenue ? Vm = 24 L/mol. Quantité de matière de HCl(g) = n = V/Vm = 48/24 = 2,0 mol. HCl(g) +H2O(l)=H3O+aq +Cl-aq. n(H3O+aq ) = n = 2,0 mol [H3O+aq ] = n / volume de la solution en litre = 2,0 / 1000 =2,0 10-3 mol/L. pH = - log [H3O+aq ] = - log(2,0 10-3) =3 - log 2 = 3-0,3 = 2,7.
On plonge une lame de zinc dans une solution de
sulfate de cuivre. La couleur bleue de la solution
disparaît,la lame de zinc se recouvre d'un
dépôt rougeâtre. La
transformation est totale. La couleur bleue initiale est due aux ions Cu2+aq ; le dépôt rouge est du cuivre métallique. Réduction des ions cuivre (II) en cuivre métallique : Cu2+aq + 2e- = Cu(s). Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn(s) = Zn2+aq + 2e-. Cu2+aq + Zn(s) = Cu(s) + Zn2+aq. Quel est le type de transformation observée ? Les quantités de matière des réactis sont modifiées : donc transformation chimique. La masse de cuivre déposée est m = 127 mg. le volume de la solution est égal à 100 mL. m(Cu) = 63,5 g/mol) Quelle était la concentration initiale des ions Cu2+aq ? n(Cu) finale = m / M = 127 / 63,5 = 2,00 mmol. n(Cu2+aq) initiale = n(Cu) finale = 2,00 mmol. [Cu2+aq] = n(Cu2+aq) initiale /V = 2,00 / 100 = 2,00 10-2 mol/L.
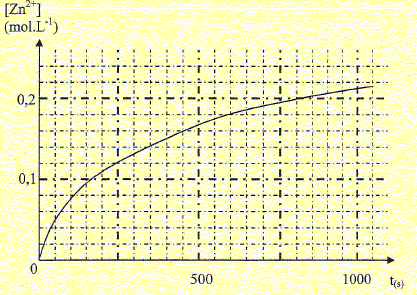
L'acide chlorhydrique réagit sur Ie zinc suivant l'équation de réaction supposée totale : 2H30+aq + Zn (s)= H2 (g)+Zn2+aq+2H2O(l) A l'instant t = 0 s, on introduit une masse m = 1,0 g de zinc en poudre dans un ballon contenant v = 40 mL d'une solution d'acide chlorhydrique de concentration molaire CA = 0,50 mol/L. On mesure Ie volume V de dihydrogène formé au cours du temps. L'avancement x de la réaction à une date t est égal àla quantité de matière d'ions Zn2+aq formés à cette date. JustifIer"(on pourra s'aider d'un tableau d'avancement).
Si le zinc est en défaut 1,5 10-2-xmax = 0 ; xmax =1,5 10-2 mol
dihydrogène atteint V = 0,125 L. n(H2) = x = V / Vm =0,125/25 = 5,0 10-3 mol. [Zn2+aq] = x/v = 5,0 10-3 / 40 10-3 = 5/40 = 0,125 mol/L ~0,13 mol/L.
|
|||||||||||||||||||||||||||||||||||
|
|