|
QCM chimie concours paramédicaux ( Kiné Poitiers, concours blanc) |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
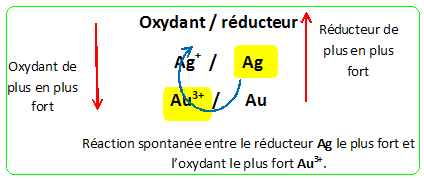
Analyse : Une lame d'argent plongée dans une solution aqueuse de nitrate d'or III se recouvre d'un dépôt d'or : Couples oxydant / réducteur : Au3+(aq) /Au(s) ; Ag+(aq) / Ag(s). Les ions Au3+(aq) se réduisent en Au(s) : Au3+(aq) + 3e- = Au(s). Au3+(aq) est un oxydant plus fort que Ag+(aq) et Ag(s) est un réducteur plus fort que Au(s)
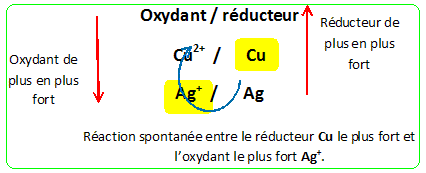
Rien ne se passe lorsqu'on la plonge( lame d'argent) dans une solution de nitrate de cuivre II. Couples oxydant / réducteur : Cu2+(aq) /Cu(s) ; Ag+(aq) / Ag(s). Les ions Cu2+ (aq) ne se réduisent pas en Cu(s) : Cu2+ (aq) est un oxydant plus faible que Ag+(aq).
-A : L'argent est plus réducteur que l'or. Vrai. -B : L'ion or est l'oxydant le plus fort des 3 cations étudiés. Vrai. -C : Le cuivre est le métal le plus réducteur des 3 métaux étudiés. Vrai. -D : Une lame d'or plongée dans une solution de nitrate de cuivre se recouvre de cuivre. Faux. Au(s) est un réducteur plus faible que Cu(s) ; Cu2+(aq) est un oxydant plus faible que Au3+(aq) : rien ne se passe. -E : L'ion argent est un oxydant Vrai. C'est l'oxydant du couple Ag+(aq) / Ag(s) : l'oxydant Ag+(aq) peut gagner un électron et se réduire en Ag(s).
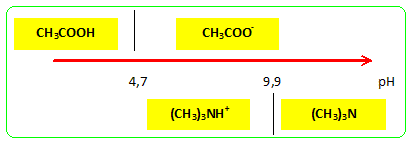
CH3COOH /
CH3-COO- : pKa1 =
4,7 ; ion triméthylammonium /
(CH3)3N : pKa2 =
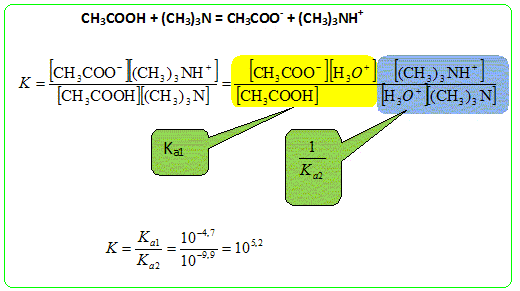
9,9 ; (CH3)3NH+ = (CH3)3N + H+. - B : Les domaines de prédominance de la triméthylamine et de l'acide éthanoïque sont disjoints. Vrai.
- C : La réaction entre la triméthylamine et l'acide éthanoïque est une réaction quasi totale. Vrai. La constante K étant grande, la réaction est quasi totale. - D : La constante de la réaction entre la triméthylamine et l'acide éthanoïque vaut 10 5,2. Vrai.
- A : L'acide aminoéthanoïque est l'acide conjugué de l'ion +H3N- CH2-COOH. Faux. acide aminoéthanoïque, base du couple : +H3N- CH2-COOH / H2N- CH2-COOH. acide aminoéthanoïque, acide du couple : H2N- CH2-COOH / H2N- CH2-COO-. - B : Lors de la réaction H- + H2O = H2 + HO-, l'ion hydrure de formule H-, est le réducteur. Vrai. couple oxydant / réducteur : H2 / H-: H- = ½H2 + e- couple oxydant / réducteur : H2O /H2 : H2O + e- = ½H2 + HO- - C : L'ion hydrure est une base ; son acide conjugué est le dihydrogène H2. Vrai. Une base est susceptible de gagner un proton : H-+ H+ = H2 - D : L'ion oxyde est une base. Vrai. couple acide /base HO- / O2- : O2- + H+ = HO-.
Données : L'oxydant du couple (O2 / H2O) est moins fort que l'oxydant du couple(Cl2 / Cl-) Enoncé : Soit une
solution aqueuse de dichlore contenant initialement 0,1
mol.L-1 de dichlore.
Le dichlore peut également se dismuter : Cl2+ H2O = Cl- + ClO- +2H+. - A : On peut affirmer que le dichlore oxyde l'eau lentement. Vrai. - B : La réaction entre l'eau et le dichlore est une réaction naturelle. Vrai. - C : Au bout d'un temps très long, le pH de la solution augmente. Faux. Il se forme ses ions H+ ; la solution devient plus acide ; le pH diminue. - D : La masse de dichlore dissoute par litre diminue au cours du temps. Vrai. Le dichlore est un ractif : la
quantité de matière de ce dernier diminue avec
le temps.
Mélange acide fort et base forte en proportions stoechiométriques. - B : Dans le mélange [Cl-] = [K+] = 2 mmol.L-1. Vrai. [Cl-] = [K+] = 2 10-4/0,1 = 2 10-3mol/L = 2 mmol/L - C : Dans le mélange final à l'équilibre il n'y a plus d'ions hydronium et d'ions hydroxydes. Faux. à pH=7, à 25°C : [H3O+]=[HO-] 10-7 mol/L. - D : Lors du mélange la seule réaction est l'autoprotolyse. Faux. Il y a autoprotolyse et une réaction acide base H3O+ +HO- =2H2O Les ions K+ et Cl- ne sont ni des acides ni des bases.
Enoncé: Dans 20 mL d'une solution de sulfate de fer III, on ajoute de la poudre de fer en excès. On agite puis on filtre. Au filtrat on ajoute 1,0 cm3 d'acide sulfurique concentré. Après refroidissement on dose la solution obtenue par une solution de permanganate de potassium à 0,024 mol.L-1. Il faut ajouter 20,5 mL pour obtenir une coloration rose persistante. Que vaut la concentration en ion Fer III dans la solution initiale? A: 0,123 mol.L-1 B: 2,46.10-2 mol.L-1 C: 0,615 mol.L-1 D: 8,20.10-2 mol.L-1. MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O 5Fe2+ + 5 e- = 5Fe3+. MnO4- + 8 H+ + 5Fe2+ = Mn2+ + 4H2O + 5Fe3+. Quantité de matière à l'équivalence : n(Fe2+) = 5 n(MnO4- ) = 5 * 0,024*20,5 10-3 = 2,46 10-3 mol. D'après les nombres stoechiométriques de (1) : n(Fe3+) = 2/3 n(Fe 2+) = 2/3 *2,46 10-3 =1,64 10-3 mol dans 20 mL [Fe3+]initial = 1,64 /20 =8,2 10-2 mol/L.
- A : Le pH-mètre mesure la conductance de la solution. Faux. Le pH-mètre mesure le pH ; le conductimètre mesure la conductance. - B : Le pH mesuré est égal à 11,4. L'avancement final est xf = 8 10-13 mol. Faux.
[HO-(aq)] =xfin /V = xfin/0,2 : xfin=2,51 10-3 *0,2 =5,0 10-4 mol. - C : L'ammoniac NH3 est un acide. Faux. C'est la base du couple acide / base NH4+ (aq)/ NH3(aq) - D : La réaction de l'ammoniac sur l'eau est : NH3(g) + H2O = NH4+ + HO-. Faux. il vaudrait mieux écrire : NH3(aq) + H2O(l) = NH4+ (aq) + HO-(aq).
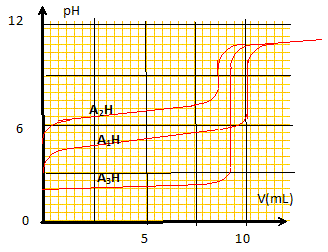
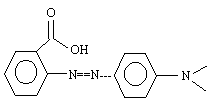
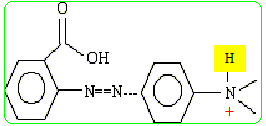
- A : La molécule représentée donne un couleur rouge à la solution. Faux. En milieu très acide un proton se fixe sur l'azote :
- B : En milieu neutre, l'indicateur coloré teinte la solution en jaune à 25°C. Vrai. La teinte est rouge à pH inférieur à pKa-1 (soit 4,2). La teinte est jaune à pH suprieur è pKa+1 (soit 6,2) - C : Lorsque l'indicateur est dans un milieu dont le pH est 7,2, la proportion de l'espèce acide est d'environ 1%. Vrai. pH = pKa + log ([A-] /[AH]) ; log ([A-] /[AH]) = 7,2-5,2 = 2 ; [A-] /[AH] = 100. - D : Le rouge de méthyle possède une fonction acide carboxylique. Vrai. groupe -COOH.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|