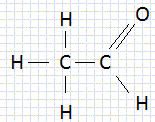|
Ester, oxydoréduction : constante d'équilibre, quotient de réaction concours kiné Nantes 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'hydrolyse en milieu acide (H2SO4) de cet ester donne deux composés A et B. Le composé B peut être obtenu par oxydation ménagée de A. Identifier A, B et E. Nommer les. L'hydrolyse donne un acide carboxylique et un alcool. L'oxydation ménagée conserve le squelette carboné : A et B possèdent le même nombre d'atomes de carbone soit 6 / 2 =3. B : CH3-CH2-COOH acide propanoïque. Seul un alcool primaire conduit par oxydation ménagée à un acide carboxylique. A : CH3-CH2-CH2OH propan-1-ol. E : CH3-CH2-COO-CH2-CH2-CH3 propanoate de propyle. Ecrire l'équation chimique de l'hydrolyse de E. CH3-CH2-COO-CH2-CH2-CH3 + H2O = CH3-CH2-COOH + CH3-CH2-CH2OH. L'hydrolyse de l'ester est lente, athermique et
limitée. L'acide sulfurique joue le rôle de
catalyseur. La réaction inverse de l'hydrolyse est
l'estérification. Déterminer la constante d'équilibre K de la réaction d'hydrolyse.
K= [A]f[B]f / ([E]f[H2O]f) = (0,34/0,66)2 =0,2654 ~ 0,27. Un mélange initial, constitué d'une mole d'ester et de n moles d'eau, conduit à un mélange final ne contenant plus que 0,30 mol d'ester. Déterminer n.
0,2654 = 0,702 / (0,30(n-0,70)) ; 0,0796 (n-0,70) = 0,49 ; n = 0,70 +6,15 ; n = 6,9. On fait réagir l'ester avec une solution concentrée d'hydroxyde de sodium. Ecrire l'équation chimique de la réaction. Préciser le nom et les caractéristiques de cette réaction. CH3-CH2-COO-CH2-CH2-CH3 + (Na+ + HO-) = CH3-CH2-COO- +Na+ + CH3-CH2-CH2OH. La saponification ( hydrolyse basique ) de l'ester est lente et totale.
La constante d'équilibre de la réaction suivante est K = 3,2. Ag+aq + Fe2+aq = Ag(s) + Fe3+aq. On introduit dans un becher V1 = 100 mL d'une solution aqueuse d'ion Ag+aq de concentration c1 = 0,10 mol/L et V2 =100 mL d'une solution aqueuse d'ion Fe2+aq de concentration c2 = 0,20 mol/L. Quelle est la valeur initiale Q r i du quotient de réaction ? Dans quel sens évolue le système ? Q r i = [Fe3+aq]i / ([Ag+aq]i [Fe2+aq]i) ; or [Fe3+aq]i = 0 donc Q r i =0. Q r i < K, donc évolution spontanée dans le sens direct. Calculer les concentrations des différents ions lorsque l'équilibre est atteint.
[Fe2+aq]f =(0,02-xf) / (V1 +V2 ) = (0,02-xf) /0,2 = 5 (0,02-xf) [Fe3+aq]f =xf / (V1 +V2 ) = xf /0,2 = 5 xf. K = [Fe3+aq]f / ([Fe2+aq]f [Ag+aq]f ) ; 3,2 = xf / [5(0,01-xf)(0,02-xf)] 16(0,01-xf)(0,02-xf) = xf ; xf2 -0,0925 xf +2 10-4 =0 ; xf = 2,215 10-3.
[Fe2+aq]f =5 (0,02-xf) = 5 (0,02 -2,215 10-3) =8,893 10-2 mol/L. [Fe2+aq]f ~ 8,9 10-2 mol/L. [Fe3+aq]f = 5 xf = 5*2,215 10-3 =1,108 10-2 mol/L. [Fe3+aq]f ~ 1,1 10-2 mol/L. Quelle masse d'argent métal obtient-on à l'équilibre ? m = xf M = 2,215 10-3 *108 =0,239 g ~ 0,24 g. On plonge une tige d'argent dans la solution. Que se produit-il ? Justifier. Le quotient de réaction et la constante d'équilibre sont indépendants de la masse d'argent : donc il ne se passe rien.
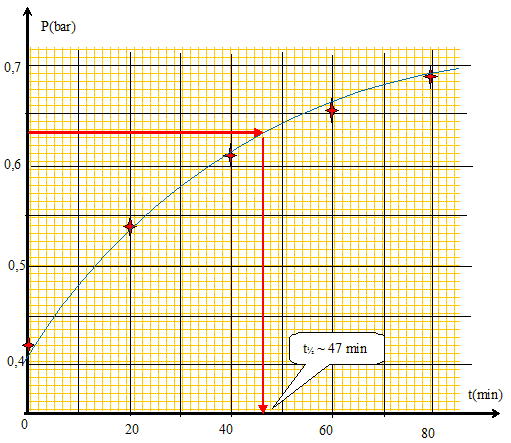
Définir le temps de demi-réaction t½. Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Calculer la pression totale P=P½ à la date t½. Déterminer graphiquement t½. xf = n0 ; xt½ = 0,5 n0 ; ntotal =n0 + 0,5 n0 = 1,5 n0 ; or pression et quantité de matière sont proportionnelles, d'où : P½ = 1,5 Pinitiale P½ =1,5*0,42 =0,63 bar.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|