|
Constante d'équilibre, électrolyse, radioactivité, chute libre : concours manipulateur radio ( St Germain 2008) |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
La transformation qui se produit est modélisée par l'équation chimique : HNO2 (aq) +F-(aq) = HF(aq) +NO2-(aq) ; constante d'équilibre K = 0,74. Ecrire l'expression littérale de cette constante d'équilibre. K =[HF(aq)]éq[NO2-(aq)]éq / ( [F-(aq)]éq [HNO2 (aq)]éq ) Calculer le quotient initial de réaction. Q r i =[HF(aq)]i[NO2-(aq)]i / ( [F-(aq)]i [HNO2 (aq)]i ) = 1. Toutes les espèces ont initialement la même concentration.
Q r i est supérieur à
K, le critère d'évolution
spontané indique une évolution dans
le sens indirect, vers la gauche.
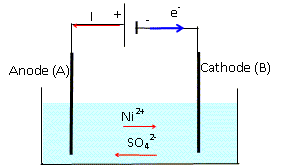
K = (n0 +xf)2 / (n0 -xf)2. Le nickel métallurgique obtenu à partir du minerai contient des impuretés. On le purifie par électrolyse. L'électrolyte utilisé est une solution de sulfate de nickel. Une des électrodes A est la plaque de nickel à purifier. L'autre électrode B est une plaque de nickel pur. Pendant l'électrolyse, le nickel contenu dans A s'oxyde et disperse ses impuretés dans la solution électrolytique. La réaction qui a lieu dans l'électrolyseur est : Ni(s) + Ni2+(aq) = Ni(s) + Ni2+(aq) Le générateur débite un courant d'intensité I supposée constante, de valeur 2,0 A sous une tension de 4,0 V pendant 5 heures. Ecrire les demi-équations des réactions ayant lieu aux électrodes A et B dans le sens où elles se produisent. A, anode, oxydation du nickel : Ni(s) = Ni2+(aq) + 2e-. B, cathode, réduction de Ni2+(aq) : Ni2+(aq) + 2e- = Ni(s). Faire un schéma du dispositif en indiquant le sens du courant, le sens de circulation des électrons et les bornes du générateur. Justifier. L'anode, le nikel impur est relié à la borne positive du générateur ; à cette électrode le nikel impur s'oxyde.
Etablir l'expression littérale entre la quantité de matière de nickel qui s'oxyde et les données du texte. Calculer sa valeur. Aide au calcul : F=96500 C; 5*36/965 = 0,18. Quantité de matière d'électricité : Q= I t avec I= 2,0A et t = 5*3600 s Quantité de matière d'électrons : n = Q/F = I t / F Quantité de matière de nickel (mol) : n(Ni) = ½n = ½I t / F n(Ni) = 0,5*2,0*5*3600/96500 = 0,5*2*0,18 = 0,18 mol.
22994Pu + 10n --> 135ZTe + A42Mo + 310n. Masses des nucléides en MeV/c2 : m(22994Pu) =222,655 103 ; m( 10n) =932 ; m(135ZTe) =125,662 103 ; m(A42Mo) =94,920 103. Masse atomique molaire de 22994Pu : M =239 g/mol ; NA = 6 1023 mol-1 ; 1 MeV/c2 =1,6 10-13 J ; 209*1,6 = 330 ; 209/1,5 = 130. Cette réaction est-elle une fusion ou une fission. Justifier. Un noyau lourd instable se casse ne deux noyaux plus légers et plus stables : donc fission. Enoncer les deux lois de conservation et déterminer A et Z. Conservation de la charge : 94 = Z +42 ; Z = 52. Conservation du nombre de nucléons : 229+1 = 135+A+3 ; A = 92. Vérifier que la perte de masse de cette réaction est égale à -209 MeV/c2 . Détailler le calcul. Dm = 2 m( 10n) + m(135ZTe) + m(A42Mo) -m(22994Pu) Dm = 2*932+103(125,662 +94,920-222,655) = -209 MeV/c2. Que vaut en MeV et en Joule l'énergie libérée. E = 209 MeV ou 209*1,6 10-13 = 330 10-13 = 3,3 10-11 J.
|
|||||||||||||||||||||||||||||||
|
|