|
Acide valérique concours kiné Ceerrf 2009. |
|||||||
|
|||||||
|
M= 102 g/mol ; température de fusion : -35 °C ; températue d'ébullition : 186 °C ; densité à 20 °C : d = 0,94 ; solubilité dans l'eau à 20 °C : s = 33 g/L. Dans l'industrie on synthètise l'acide valérique par oxydation ménagée d'un alcool qu'on notera B. Le nom courant de B est alcool "amylique", sa formule est C5H12O et sa chaine carbonée est linéaire. Donner le nom et la formule d'un réactif qui pourrait permettre l'oxydation ménagée de B en AH. Permanganate de potassium en milieu acide ; KMnO4. Expliquer pourquoi B ne peut être que le pental-1-ol, d'après ce qui est écrit plus haut. La chaine carbonée est linéaire et seul un alcool primaire peut conduire par oxydation ménagée à un acide carboxylique.
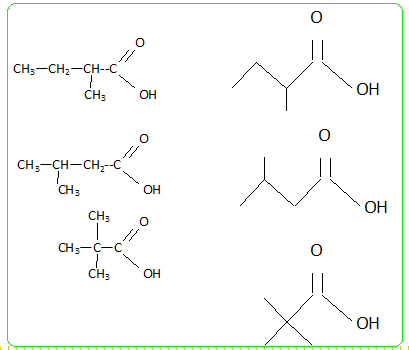
CH3-CH2-CH2-CH2-COOH
acide pentanoïque CH3-CH2-CH (CH3)-COOH acide 2-méthylbutanoïque CH3-CH (CH3)-CH2-COOH acide 3-méthylbutanoïque (CH3)3C-COOH acide 2,2-diméthylpropanoïque.
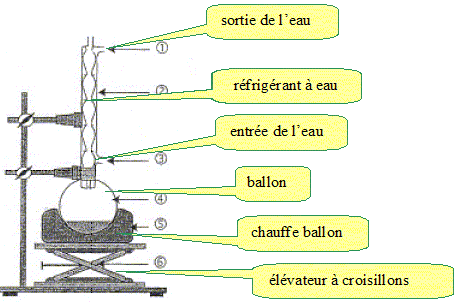
Etape 1 : introduire dans un ballon la racine de valériane hachée menu, ajouter 100 mL d'eau et des grains de pierre ponce. Placer le ballon dans un chauffe ballon et surmonter le ballon d'un réfrigérant à eau. Etape 2 : porter le mélange à ébullition et maintenir l'ébullition durant 30 min. Etape 3 : refroidir à 20 °C puis filtrer le contenu du ballon. Faire un schéma du montage de l'étape 2 en indiquant le sens de circulation de l'eau dans le réfrigérant. Comment s'appelle ce montage ? Chauffage à reflux :
AH + HO- = A- + H2O. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométrique cV = c' VE ; c = c' VE /V = 1,00 10-2 * 9,2 / 10 = 9,2 10-3 mol/L. L'acide valérique utilisé était -il réellement pur ? Justifier. masse d'acide AH dans 1 mL : volume (mL) * densité = 1,00 */ 0,94 = 0,94 g n=m/M = 0,94 / 102 = 9,2 10-3 mol dans 1 L : l'acide AH est pur.
|
|||||||
|
c |
|||||||
|
|