|
Pile, électrolyse, transformations inversables concours kiné Ceerrf 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On considère la transformation modélisée par l'équation : Ni(s) + Cu2+aq = Cu(s) + Ni2+aq de constante d'équilibre K = 2 1019. Les solutions utilisées ont toutes deux les concentrations de 0,10 mol/L en ions Cu2+aq et Cu2+aq et un volume V = 200 mL dans chaque compartiment. Exprimer puis calculer le quotient de réaction initial Qr i relatif à l'équation écrite précédemment. Qr i =[Ni2+aq]i / [Cu2+aq]i = 0,10 / 0,10 = 1. Dans quel sens va évoluer le système si on relie les plaques métalliques par un conducteur ohmique ? Justifier. Qr i < K, donc évolution dans le sens direct. On fait débiter par la pile ainsi obtenue, un courant d'intensité I= 20 mA pendant 10 heures. Quel est l'avancement de la réaction au bout de cette durée ? Aide au calcul : 72/193 = 0,37. Quantité d'électricité : Q = I t = 0,02 * 10*3600 = 720 C Quantité de matière d'électrons n(e-) = Q / 96500 = 720 / 96500 = 72 / 9650 mol Or Cu2+aq + 2e- = Cu(s) d'où la quantité de matière de cuivre : n(Cu(s) = ½n(e-) = 72/( 2*96,5*100) = 72 / 193 10-2 = 3,7 10-3 mol. L'avancement est égal à la quantité de matière de cuivre formé : x = 3,7 10-3 mol. 0,02-3,7 10-3 =0,0163 = 0,0237 Calculer le quotient de réaction final Q r 10 et le comparer à Q r i et K. Faire un commentaire sur l'état d'évolution du système. Qr 10 =[Ni2+aq]f / [Cu2+aq]f = 0,1185 / 0,0815 =1,45 ~ 1,5. Valeur supérieure à Qr i mais inférieur à K : le système va encore évoluer dans le sens direct tant que le circuit extérieur sera fermé.
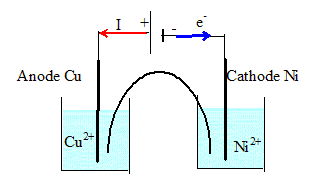
Ecrire son équation. Cu(s) + Ni2+aq = Ni(s) + Cu2+aq de constante d'équilibre 1/ K = 1/ 2 1019 =5 10-20. Faire un schéma légendé du montage en précisant la nature des pôles de chaque dipôle.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|