|
Titrage par conductimétrie de l'ion magnésium concours kiné Assas 2009. |
|||||||
|
|||||||
|
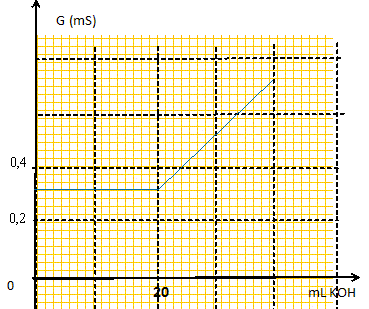
Le titrage s'effectue par ajout d'une solution d'hydroxyde de potassium de concentration en soluté apporté égale à 1,00 10-2 mol/L. Cet ajout entraîne la précipitation de l'hydroxyde de magnésium. Le graphe ci dessous représente la variation de la conductance G( mS) du mélange réactionnel en fonction du volume V( mL) d'hydroxyde de potassium ajouté.
Avant l'équivalence, l'ion Mg2+ est en excès : du point de vue de la conductimétrie, tout se passe comme si on remplaçait l'ion magnésium par deux ions potassium. Mg2+aq + 2K+aq +2 HO- aq = Mg(OH)2 (s) + 2K+aq Or lMg2+ = 10,5 10-3 S m2 mol-1 et lK+ =7,40 10-3 S m2 mol-1 . La conductivité de la solution ( donc la conductance) reste à peu près constante. on ajoute à la solution des ions
hydroxyde et potassium. Or lHO- =
19,8 10-3 S m2
mol-1 est assez grande. La conductivité( donc la conductance) de
la solution va croître assez rapidement. L'intersection des deux segments donne le volume
équivalent VE = 20,0
mL. Mg2+aq +2 HO- aq = Mg(OH)2 (s) A l'équivalence : quantité de matière d'ion hydroxyde : 20,0 10-3 * 1,00 10-2 = 2,00 10-4 mol. D'après les nombrs stoechiométriques de l'équation support du dosage : n(Mg2+ ) = ½n(HO- )= 1,00 10-4 mol dans 0,1 L de solution [Mg2+] = 1,00 10-4 /0,1 = 1,00 10-3 mol/L.
Calculer la conductivité et la conductance de la solution S0. Ions présents dans la solution initiale : HO-aq, H3O+aq, Mg2+aq et Cl- aq. Concentration : [HO-aq] = [H3O+aq] = 1,0 10-7 mol /L = 1,0 10-4 mol m-3. [Mg2+aq] =1,0 mol m-3 ; [Cl- aq] = 2 [Mg2+aq] =2,0 mol m-3. lMg2+ = 10,5 10-3 S m2 mol-1 ; lHO- =19,8 10-3 S m2 mol-1 ; lH3O+ = 35,0 10-3 S m2 mol-1 ; lCl- =7,60 10-3 S m2 mol-1 . Conductivité s = lMg2+[Mg2+aq] + lCl- [Cl- aq] + lHO- [HO-aq] + lH3O+[H3O+aq] s = 10-3 [10,5 + 7,6*2 +19,8* 10-4 +35 *10-4 ] = 2,57 10-2 S m-1. Constante de cellule : k = S/e = 5,00 10-4 / 4,00 10-2 =0,0125 m Conductance G = k s =0,0125*2,57 10-2 = 3,21 10-4 S = 0,321 mS = 321 µS.
|
|||||||
|
c |
|||||||
|
|