|
Acide base : pH, conductivité ; oxydoréduction : pile, électrolyse concours kiné 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
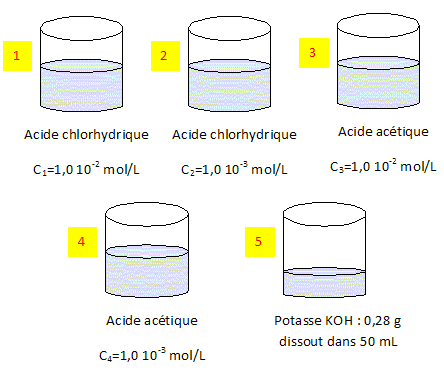
Analyse : acide faible, acide fort. A-C-E- L'acide chlorhydrique est "fort", entièrement dissocié dans l'eau ; pKa ( H3O+ / H2O = 0) Le pH de la solution (1) est égal à : pH =-log c = - log 10-2 = 2. L'acide acétique ( éthanoïque) est "faible", partiellement dissocié dans l'eau : pKa ( CH3COOH / CH3COO- = 4,8) Le pH de la solution (3) vaut : pH = pKa + log ([CH3COO-] /[CH3COOH]). A concentration égale, un acide est d'autant plus fort que son pKa est plus petit ; le pH de la solution (3) est supérieur au pH de la solution (2). Analyse : dilution. B- En diluant 10 fois la solution (1) on obtient la solution (2) ; en diluant 10 fois un acide fort de concentration 0,01 mol/L, le pH augmente de log 10 = 1 unité. D- En diluant 10 fois la solution (3) on obtient la solution (4) ; en diluant 10 fois un acide faible de concentration 0,01 mol/L, le pH augmente de moins de 1 unité. Le pH de la solution (3) est donc plus petit que celui de la solution (4). La potasse ( solution 5 ) est entièrement
dissociée dans l'eau : c'est une base
forte. pH = 14 + log
c. Masse molaire KOH : M = 39 + 16+1 = 56
g/mol. Quantité da matière ; n = m / M =
0,28 / 56 = 0,005 mol Concentration c = n / V = 0,005 / 0,05 = 0,1
mol/L pH ( solution 5) = 14 + log 0,1 = 14-1 =
13. Analyse : conductivité. L'acide faible noté AH est partiellement dissocié dans l'eau ; la base conjuguée est notée A- ; le tableau suivant est réalisé pour un volume V = 1 L de solution.
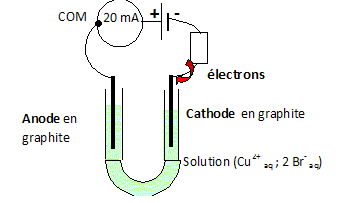
[A-]f=[H3O+]f = xf /V mol/L = 103xf /V mol m-3. s = lA- [A-]f + lH3O+ [H3O+]f = ( lA- + lH3O+ ) [H3O+]f =0,02 S m-1. On donne ( lA- + lH3O+ ) = 4,0 10-2 S m2 mol-1. [H3O+]f =0,02 / 0,04 = 0,50 mol m-3 = 5,0 10-4 mol /L. Analyse : taux d'avancement final. t = [H3O+]f / c = 5,0 10-4 / 1,0 10-3 = 0,5.
Le zinc métal oxyde lentement le diiode, seule espèce colorée. Le diiode étant l'un des réactifs, la teinte jaune brune de la solution s'atténue lentement.
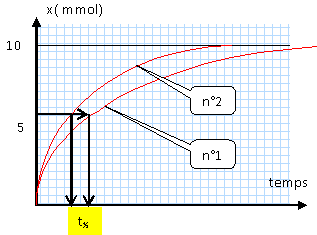
A- A concentration égale, la réaction est d'autant plus rapide que la température est plus élevée. La solution 4 se décolore très vite, par rapport à la solution 1. Analyse : facteur cinétique, la concentration d'un réactif. F- A température identique, la réaction est d'autant plus rapide que la concentration initiale en diiode est plus élevée. En cours de réaction, la concentration en diiode diminue, la vitesse de la réaction diminue donc au cours du temps. Analyse : temps de demi-réaction. Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Ici la réaction est totale, l'avancement final est égal à l'avancement maximal. C- D - expérience n°1 : 25°C et conditions stoechiométriques, xf = 10 mmol et xt½ = 5 mmol. expérience n°2 : 25°C, le zinc est le réactif limitant et le diiode est en excès, xf = 10 mmol et xt½ = 5 mmol.
Analyse : concentration finale en ion iodure. B- expérience n°1 : 25°C et conditions stoechiométriques, xf = 10 mmol et n(iodure) =2 xf = 20 mmol. expérience n°3 : 25°C, le zinc est le réactif limitant et le diiode est en excès, xf = 10 mmol et n(iodure) =2 xf = 20 mmol.
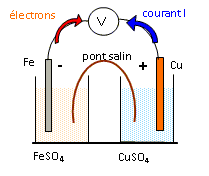
Le fer est oxydé et libère des électrons ; le fer constitue l'anode négative de la pile : Fe(s) = Fe2+(aq) + 2e-. Les ions cuivre Cu2+(aq) sont réduits à la cathode positive : Cu2+(aq) + 2e- = Cu(s) Bilan : Fe(s) + Cu2+(aq) = Fe2+(aq) +Cu(s). C-E- La masse de l'électrode de fer diminue, la masse de l'électrode de cuivre augmente.
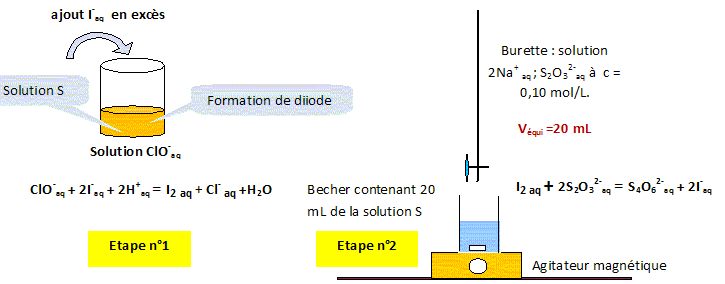
Analyse : dosage indirect : On réalise un dosage indirect si la réaction support du dosage n'est pas suffisamment rapide ou bien si l'on ne possède pas d'indicateur coloré mettant en évidence le point équivalent. Ce type de dosage met en oeuvre deux réactions rapides. Analyse : indicateur coloré, étape n°2 : Le diiode est la seule espèce colorée ( teinte jaune brune ) ; en présence de diiode, l'empois d'amidon donne une teinte violette assez foncée. Avant l'équivalence le diiode est en excès ( teinte violette) Après l'équivalence toutes les espèces sont incolores. B- A l'équivalence la teinte passe du violet à l'incolore. Analyse : concentration en ion hypochlorite : Etape n°2 : à l'équivalence n(I2) = 0,5 n(S2O32-) ; n(I2) = 0,5 * c Véqui = 0,5*0,1 * 20 10-3 =1,0 10-3 mol. n(I2) =1,0 10-3 mol dans 20 mL de la solution S. [I2] = 1,0 10-3 / 20 10-3 =0,05 mol/L. C- Etape n°1 : les nombres stoechiométriques indiquent [I2] =[ClO-] = 0,05 mol/L.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||