|
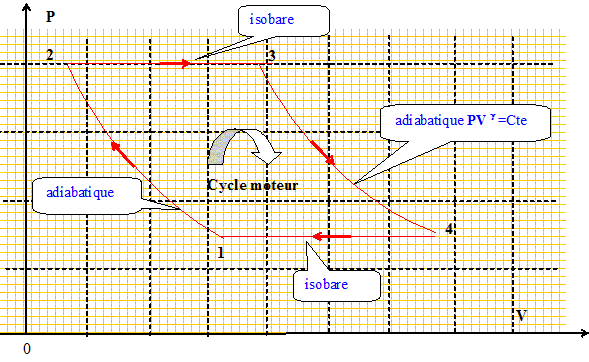
Turbine : cycle moteur : adiabatique, isobare concours physique ITPE 2009. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
On note g = cp/cv, les capacités thermiques sont exprimées en J K-1 mol-1. Etablir pour un gaz parfait la relation : S2-S1 = cp ln ( T2/T1) -nR ln( P2/P1). dQ = ncvdT + PdV = ncpdT - VdP avec V = nRT/P ; dQ = ncpdT + nRT/P dP dS = dQ/T = ncp/TdT + nR/P dP , puis intégrer : S2-S1 = cp ln ( T2/T1) -nR ln( P2/P1) On rappelle la relation de Meyer cp-cv = nR. En déduire les expressions de cpet cv en fonction de n, R et g. g = cp/cv donne cp = cvg puis repport dans la relation de Meyer : cvg -cv = nR ; cv = nR /( g -1) ; cp= nRg /( g -1). En déduire la
realtion de Laplace en fonction de P et
T. Lors d'une tranformation adiabtique
réversible d'un gaz parfait PVg=
cste Loi des gaz parfaits : PV = nRT ; V = nRT/P
d'où : P ( T/P)g
= cste soit
P1-g
Tg=
cste.
(1) à (2), transformation adiabtique réversible : P11-g T1g =P21-g T2g ; T2 = T1[P1 /P2 ](1-g) / g . (3) à (4), transformation adiabtique réversible : P31-g T3g =P41-g T4g ; Or P3 = P2 et P4 = P1 : les transformations 2-->3 et 4-->1 sont isobares ; par suite : T4 = T3[P2 /P1 ](1-g) / g . Etablir les expressions des travaux et des transferts thermiques en fonction des températures. 1-->2, diabatique réversible : Q12=0 ; la variation d'énergie d'un gaz parfait ne dépend que de la température : DU12 = ncvDT = W12. W12 = ncv(T2-T1). Même travail pour l'adiabatique réversible 3-->4 : Q34=0 ; W34 = ncv(T4-T3). 2-->3, isobare ; W23 = -P2DV = -P1(V3-V2) =P2V2 -P2V3 = P2V2 -P3V3 = nRT2-nRT3 ; W23 = nR (T2-T3). la variation d'enthalpie d'un gaz parfait ne dépend que de la température : DH23 = ncpDT = Q23. Q23 = ncp(T3-T2). Même travail pour l'isobare 4-->1 : W41 = nR (T4-T13) ; Q41 = ncp(T1-T4).
|
|||||||||||||||||||||||||||
|
|