Il est possible de synthètiser
industriellement le fluorure d'hydrogène selon la
réaction :
(1)
CaF2(s) + H2SO4(l) =
CaSO4(s) + 2HF(g).
On donne les enthalpies standards de formation
DrH° et les
entropies molaires standards Sm° à 25
°C :
|
|
CaF2(s)
|
H2SO4(l)
|
CaSO4(s)
|
HF(g)
|
|
DfH°
kJ mol-1
|
-1219,6
|
-814,0
|
-1434,1
|
-271,1
|
|
Sm° J mol-1
K-1
|
68,9
|
156,9
|
106,7
|
173,7
|
Définir et calculer la
variance d'un système où se produit
l'équilibre
(1).
La règle des phases donne la variance d'un
système thermodynamique : v = c+2-j
Le chiffre 2 indique le nombre de paramètres
intensifs.
c : nombre de constituants indépendants ( nombre
de constituants - nombre de réactions chimiques
indépendantes entre ces constituants)
Nombre de constituants : c=4 ; nombre de relation : 1 ;
nombre de phase : j= 4
v = c-1+2-j= 4-1+2-4 =1.
On peut faire varier la température ou la
pression.
Calculer
l'enthalpie libre standard de cette
réaction
à
298 K
?
Pour une mole de HF formé
:(1)
½CaF2(s) + ½
H2SO4(l) = ½ CaSO4(s)
+ HF(g).
DrH°
=½DrH°(CaSO4(s))
+ DrH°(HF)
-½DrH°(H2SO4(l))-½DrH°(CaF2(s))
DrH°
=
-½*1434,1-271,1
+½
*814 + ½ *1219,6
; DrH°
=
28,65 kJ
mol-1.
DrS°
=½S°(CaSO4(s))
+ S°(HF)
-½S°(H2SO4(l))-½S°(CaF2(s))
DrS°
=½*106,7+173,7-½*156,9-½*68,9
= 114,15 J mol-1 K-1
DrG°
=DrH°
-
TDrS°
=28,65
- 298*0,11415 =
-5,37
kJ mol-1
pour 1 mole de HF formé.
|
|
Calculer la
pression du fluorure d'hydrogène à
l'équilibre à 25 °C.
La constante d'équilibre s'écrit :
K = PHF.
De plus DrG°
=-RT
ln K ; ln K = -5,37 103/(-8,31*298)
=2,17
K = 8,7 d'où
PHF =
8,7 bar.
A t-on
intérêt à pratiquer cette
synthèse à faible pression ou
à haute pression ?
Si la pression augmente, le nombre de
molécules de HF croît : en
conséquence l'équilibre est
déplacé vers la gauche, sens
indirect, diminution du nombre de molécules
HF.
On a donc intérêt à
travailler à faible pression.
|
|
En phase gazeuse, le fluorure
d'hydrogène existe sous forme d'un
polymère (HF)n qui se dissocie
sous l'action d'une élévation de
température en monomère HF.
Expliquer le
phénomène impliqué dans la
polymérisation.
Les molécules de
fluorure d'hydrogène, même à
l'état gazeux, peuvent être
associées entre elles par des liaisons
hydrogène
forte.
Synthèse
du dihydrogène.
Soit la synthèse suivante :
CH4(g) + H2O(g) = CO(g) +
3H2(g).
Cette réaction se fait sous pression
totale constante Ptot = 10 bar. La
température du réacteur est constante
et à cette température, la constante
d'équilibre thermodynamique K° est
égale à 15. L'enthalpie standard de
réaction est considérée comme
indépendante de la température
DrH° =
206 kJ / mol.
Quelle
est l'approximation faite sur la capacité
calorifique de réaction à pression
constante ?
Quelle
est la conséquence sur l'entropie molaire
standard de réaction ? Sur l'enthalpie libre
standard de réaction
?
DrCp
varie très peu avec la pression si celle-ci
est peu élevée ; DrCp
est indépendant de la température si
l'intervalle de température n'est pas trop
grand.
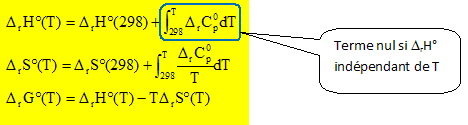
DrH°(T)
= DrH°(298)
; DrS°(T)
= DrS°(298)
; DrG°(T)
= DrH°(298)-TDrS°(298).
Exprimer la constante
d'équilibre
K
en fonction des pressions partielles et de la
pression standard P°=1
bar.
Les pressions partielles étant celles des
constituants à
l'équilibre.
|
|
|
Initialement le système contient 10
moles de méthane, 30 moles d'eau, 5 moles de
monoxyde de carbone et 15 moles de
dihydrogène.
Exprimer le quotient de
réaction Qr en fonction des
quantités de matière des constituants
et de la pression totale Ptot.
Calculer la valeur de
Qr i dans l'état
initial.
|
|
avancement (mol)
|
CH4(g)
|
+
H2O(g)
|
= CO(g)
|
+
3H2(g)
|
|
initial
|
0
|
10
|
30
|
5
|
15
|
|
en cours
|
x
|
10-x
|
30-x
|
5+x
|
15+3x
|
A la date t, nombre total de mol : N= 60+2x.
Fractions molaires :
|
xH2
=
|
15+3x
60+2x
|
;
xCO
=
|
5+x
60+2x
|
;
xCH4
=
|
10-x
60+2x
|
;
xH2O
=
|
30-x
60+2x
|
Pressions partielles :
|
PH2
=Ptot
|
15+3x
60+2x
|
;
PCO
=Ptot
|
5+x
60+2x
|
;PCH4
=Ptot
|
10-x
60+2x
|
;
PH2O
=Ptot
|
30-x
60+2x
|
Quotient de réaction :
|
Qr=
|
PH23
PCO
PCH4PH2O
|
=
P2tot
|
(15+3x)3(5+x)
(10-x)(30-x)(60+2x)2
|
Valeur du quotient de réaction dans
l'état initial : x=0
|
Qr
i=
|
= 102
|
153 *5
10*30*602
|
=1,56
|
Qr i est différent de K, le
système n'est pas à
l'équilibre.
Qr i est inférieur à K,
le système évolue spontanément
dans le sens direct.
|
Dans un nouvel état initial, le système
ne contient que 10 moles de méthane et 10 moles
d'eau.
Déterminer la composition
du système à l'équilibre.
Ptot = 10 bar.
Fractions molaires :
|
xH2
=
|
3x
20+2x
|
;
xCO
=
|
x
20+2x
|
;
xCH4
=
|
10-x
20+2x
|
;
xH2O
=
|
10-x
20+2x
|
Constante d'équilibre
|
K= Qr
éq=
|
PH23
PCO
PCH4PH2O
|
= P2tot
|
(3x)3(x)
(10-x)(10-x)(20+2x)2
|
=100
|
27x4
4(10-x)2(10+x)2
|
15 *4 (100-x2)2 = 2700 x4
; (100-x2)2 = 45 x4 ;
100-x2 = 6,71x2 ; x = 3,60
mol.
Composition du système à l'équilibre
:
|
|
avancement (mol)
|
CH4(g)
|
+ H2O(g)
|
= CO(g)
|
+ 3H2(g)
|
|
initial
|
0
|
10
|
10
|
0
|
0
|
|
à l'équilibre
|
x éq=3,6
|
10-3,6 =
6,4
|
10-3,6 =
6,4
|
3,6
|
3*3,6
=10,8
|
Quelle est l'influence d'une
élévation isobare de température sur
cet état d'équilibre ?
DrH° = 206 kJ
/ mol. : la réaction est endothermique. Une
élévation isobare de température
déplace l'équilibre dans le sens direct.
Au système à l'équilibre on ajoute
de façon isotherme et isobare, une mole de monoxyde
de carbone. Dans quel sens se
produira l'évolution ?
Le système évolue dans le sens de la
consommation de monoyde de carbone : sens indirect.
