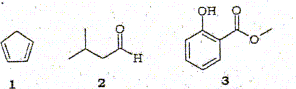|
acide fluorhydrique ; acide base et réactivité concours ingénieur Minefe 2008. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
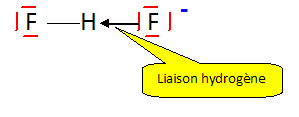
Les solutions aqueuses de fluorure d'hydrogène sont usuellement nommées solutions d'acide fluorhydrique. La réaction de déprotonation a pour constante (3) HF = H+ + F- ; K3 = 10-3,18. Elles contiennent, par ailleurs, l'ion hydrogénodifluorure qui apparaît par l'équilibre : (4) F- +HF = FHF- ; K4 = 100,67. On note c la concentration totale en élément fluor d'une solution d'acide fluorhydrique. Proposer une représentation de Lewis de l'ion FHF-, noté F2H- par la suite.
L'ion [F-H-F]- est linéaire ; il possède une liaison hydrogène forte ; l'atome d'hydrogène est à mi-chemein entre les deux atomes de fluor. Exprimer c en fonction de [HF], [F-] et de [F2H-]. Conservation de l'élément fluor : c = [HF] + [F-] + 2[F2H-] Quel serait le pH et la valeur de c, d'une solution d'acide fluorhydrique où l'on trouverait des concentrations égales en ions F- et F2H- ? On négligera l'autoprotolyse de l'eau.
[H+] = [F2H-] +[F-] = 2 [F-]
[H+] =1,68 10-2
mol/L ; pH = -log 1,68 10-2 ;
pH=1,8.
L'hypothèse faite est bien
vérifiée. Donc [F-]
=[F2H-]= 0,5*1,68
10-2 = 8,4 10-3 mol/L ;
[HF] = 10-0,67 =0,214 ; c = [HF] + [F-] +
2[F2H-] =0,214 + 8,4
10-3 + 2* 8,4 10-3 ;
c =0,24
mol/L. En déduire la
proportion de fluorure d'hydrogène qui a
globalement réagi dans les conditions de la
question précédente. 3*8,4 10-3 /0,24 = ~ 0,10
( 10
%).
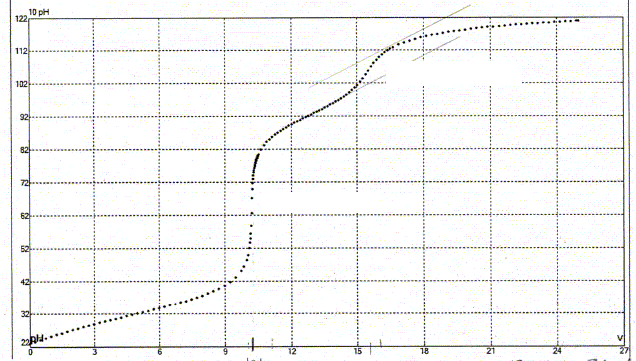
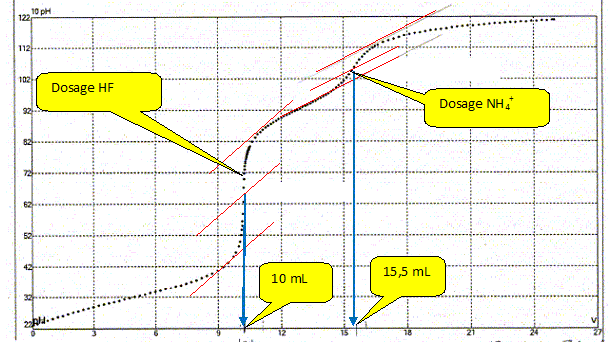
Une prise d'essai de 10,0 mL d'un mélange d'acide fluorhydrique et de chlorure d'ammonium ( pKa (NH4+ / NH3) = 9,2)) est dosé par une solution de soude CNaOH= 45,0 mmol/L. Ce dosage est suivi par pHmétrie. La courbe suivante est obtenue :
La déprotonation des composés 1 à 3 est réalisée respectivement par l'éthanolate de sodium, l'hydrure de sodium et la soude. Attribuer les valeurs de pKa : 10,15, 24 aux trois composés. (3) la déprotonation du phénol conduit à un anion dont la charge est délocalisée sur le cycle benzénique et sur le groupe ester. Ce proton est assez mobile ( acide), d'où l'attribution pKa = 10. (1) : la déprotonation conduit à un anion aromatique : la charge de cet anion est délocalisée sur le cycle à 5 atomes : ce proton est moins acide que le précédent, la charge de l'anion étant délocalisée sur un plus petit nombre d'atomes. ( pKa = 15). (2) la déprotonation conduit à un anion dont la charge est délocalisée sur 2 atomes seulement. Voici quelques pKa d'acide et de base courante :
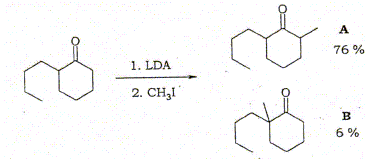
La base est d'autant plus forte que le pKa est grand ( Ka petit). (2) peut être déprotoné par NaH, NH2-, LDA, CH3MgI, n-BuLi. La méthylation de la cétone ci-dessous à -78 °C donne deux produits.
Interpréter les proportions obtenues. Les hydrogène du groupe CH2, en alpha du groupe cétone, sont plus acides que l'hydrogène en alpha ' ( à gauche) : le groupe CH3-(CH2)3- est donneur d'électrons, et en conséquence l'anion résultant du départ de H sera déstabilisé. De plus du coté gauche de ce groupe cétone il y a une gène stérique : CH3-(CH2)3- est assez volumineux.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
 ion
bifluorure
ion
bifluorure