|
Suivi conductimétrique d'une saponification concours technicien laboratoire éducation 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'équation bilan de la réaction est : CH3-COO-C2H5 + HO-aq = CH3-COO -aq + C2H5OH aq L'évolution de l'avancement x (mol) au cours du temps est déduit de la mesure de la conductivité de la solution. Dans une fiole jaugée de volume V0 = 200 mL contenant déja 100 mL d'eau distillée, on ajoute un volume V1 = 20,0 mL d'une solution de soude de concentration C1 = 1,00 10-2 mol/L puis un volume V2 = 1,00 mL d'acétate d'éthyle. Le chronomètre est déclenché après l'ajout du volume V2. On complète ensuite rapidement jusqu'au trait de jauge par de l'eau distillée. La solution est transvasée dans un bécher plongé dans un bain thermostaté dont la température est maintenue à 30°C. La conductivité est mesurée à l'aide d'un capteur approprié plongé dans la solution. Mesure de la conductivité. Quel est le nom usuel donné au capteur permettant de mesurer la conductivité de la solution ? Sonde du conductimètre : l'extrémité de la sonde de mesure comporte une lucarne ( deux faces parallèles de section "S", distantes de "d" cm) . On mesure la conductance de la portion de solution comprises entre les deux faces parallèles. Afin de convertir la mesure par le capteur de la conductance G d'une portion de solution de conductivité s, il est nécessaire de réaliser un étalonnage. Indiquer la méthode mise en oeuvre permettant de réaliser cet étalonnage. Mesurer la conductance d'une solution de KCl à 0,01 mol/L dont la conductivité est connue pour différentes températures. La conductance G (S) et la conductivité s ( S m-1) sont proportionnelles. La constante de proportionnalité ( constante de cellule) vaut k = G /s (m). Proposer, en quelques
mots, une méthode expérimentale
simple permettant d'accéder à cette
valeur. Dans une fiole jaugée de volume
V0 = 200 mL contenant déja 100 mL
d'eau distillée, on ajoute un volume
V1 = 20,0 mL d'une solution de soude de
concentration C1 = 1,00 10-2
mol/L puis on complète ensuite jusqu'au
trait de jauge par de l'eau distillée.
Mesurer la conductivité de cette
solution. Calculer la quantité de matière n1 en ions hydroxyde prélevés dans le volume V1. n1 = C1V1 = 1,00 10-2 * 20,0 10-3 =2,00 10-4 mol. Calculer la quantité de matière n2 d'acétate d'éthyle prélevés dans le volume V2. On donne M(CH3-COO-C2H5)= M= 88,1 g/mol ; densité d = 0,902 n2 =V2 *d/M= 1,00 *0,902 /88,1 = 1,02 10-2 mol. Etablir le tableau d'avancement en fonction de x, n1, n2.
Réaliser un inventaire de toutes les espèces chargées présentes dans la solution. Ion hydroxyde HO-aq ; ion sodium Na+aq ; ion acétate CH3-COO -aq. Donner en fonction de n1, V0, x et des conductivités molaires limite l° des ions impliqués, l'expression de : s0, la conductivité à l'instant t=0 : s0 = l° HO- [HO-]0 + l° Na+ [Na+]0 = (l° HO- + l° Na+ ) n1/ V0. s, la conductivité à l'instant t : s = l° HO- [HO-]t + l° Na+ [Na+]t + l° CH3COO- [CH3-COO -]t ; [Na+]t = n1/ V0 ; [HO-]t = (n1-x)/ V0 ; [CH3-COO -]t = x/ V0. s = l° HO- (n1-x)/ V0 + l° Na+ n1/ V0 + l° CH3COO- x/ V0 ; s = (l° HO- + l° Na+ )n1/ V0 + ( l° CH3COO- -l° HO-) x/ V0 ; s =s0 + ( l° CH3COO- -l° HO-) x/ V0. (1) soo, la conductivité au bout d'un temps très long, réaction terminée : soo =s0 + ( l° CH3COO- -l° HO-) xmax/ V0 = s0 + ( l° CH3COO- -l° HO-) n1/ V0 (2) Montrer que l'avancement x s'exprime simplement en fonction de s0, s, soo et n1. (2) donne : ( l° CH3COO- -l° HO-) / V0 = ( soo - s0 )/n1. repport dans (1) : s =s0 +( soo - s0 ) x / n1. x = n1 (s -s0 ) /( soo - s0 ).
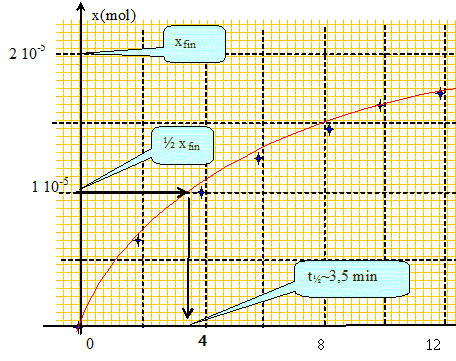
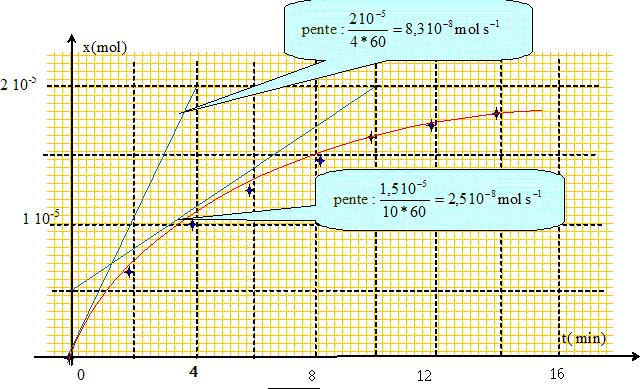
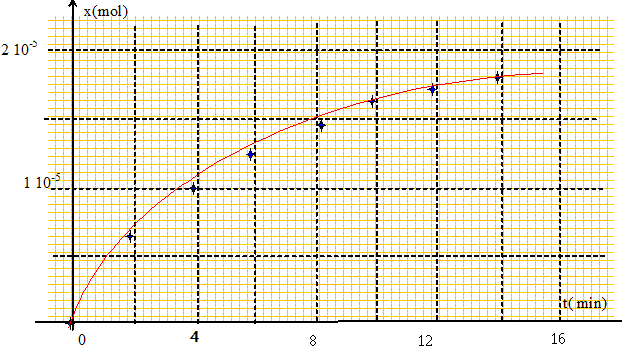
Compléter le tableau et tracer la courbe x=f(t). ( seules des deux premières lignes étaient remplies)
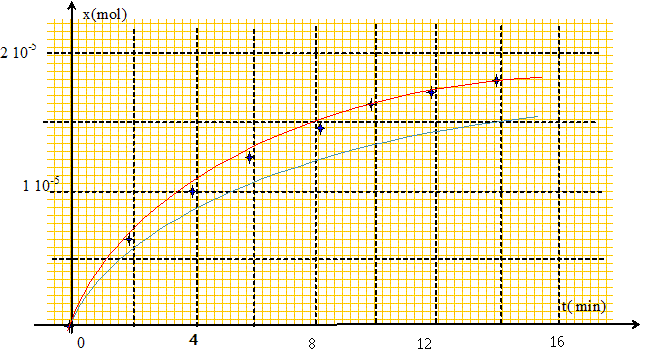
puis diviser par V0 = 0,2 L : v0 =8,3 10-8 / 0,2 =4,1 10-7 mol L-1 s-1. vt½ =2,5 10-8 / 0,2 =1,2 10-7 mol L-1 s-1. Superposer au graphe l'allure de la courbe lorsque la température est inférieure à 30 °C. La température est un facteur cinétique.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|