|
Chimie : eau de Javel commerciale : propriétés, dosage concours technicien laboratoire 2009. |
|||||||||||||
|
|||||||||||||
|
L'eau de Javel est une solution aqueuse équimolaire d'hypochlorite de sodium ( Na+ aq + ClO- aq) et de chlorure de sodium ( Na+ aq + Cl- aq ). La concentration des eaux de Javel est exprimée par la teneur en chlore actif sous la forme d'un pourcentage pondéral. Ce pourcentage correspond à la masse , exprimée en gramme de dichlore Cl2(g), nécessaire pour préparer 100 g de solution, selon l'équation bilan : Cl2(g) + 2HO-aq --> ClO- aq + Cl- aq +H2O(l). la terminologie " eau de Javel" est réservée aux solutions vendues dans le commerce dont la teneur en chlore actif est inférieure à 10 %. Pour le s teneurs plus élevées, dans l'industrie, on utilise la dénomination " hypochlorite de sodium".
R : phrases de risques ; S : phrases, conseils de sécurité. On donne ci-après un ensemble de pictogramme de sécurité trouvés sur les emballages des produits chimiques.
(7) avec la mention Xn nocif ; (3) et (4). Quel(s) est ( sont) le(s) pictogramme(s) devant être trouvé(s) pour une solution d'eau de Jave à 9,6% ? (7) avec la mention Xi irritant. L'ajout d'acide chlorhydrique à une solution d'eau de Javel provoque un dégagement de dichlore gazeux. On désigne le degré chlorométrique d'une solution concentrée d'eau de Javel comme le volume exprimé en litre de dichlore gazeux qui peut être libéré par l'addition d'acide chlorhydrique en quantité non limitante à un litre d'eau de Javel dans les conditions normales de température et de pression ( 273 K et 1,013 bar ). On cherche la correspondance entre le degré chlorométrique et le pourcentage en chlore actif d'une solution commerciale d'eau de Javel à 9,6 %. On donne la densité de la solution d = 1,158 et M( Cl) = 35,5 g/mol. 9,6 g de Cl2 dans 100 g de solution. Quantité de matière de dichlore n = m/M = 9,6 / 71 = 0,135 mol. Volume de cette solution de masse 100 g : V = 100 / d = 100 / 1,158 =86,36 mL. Concentration en dichlore : c = n/V = 0,135/86,36 = 1,56 mol/L d'après Cl2(g) + 2HO-aq --> ClO- aq + Cl- aq +H2O(l) , c(ClO-) = 1,56 mol/L. Ecrire l'équation bilan de la réaction entre une eau de Javel et une solution d'acide chlorhydrique. On indiquera les couples oxydant / réducteur. ClO- aq /Cl2(g) et Cl2(g) / Cl- aq ClO- aq + Cl- aq + 2H+ aq = Cl2(g) +H2O(l). Calculer le degré chlorométrique de la solution commerciale. c(Cl2(g)) = n(ClO- aq) = 1,56 mol Volume de dichlore gazeux : Vmolaire n = 22,4 * 1,56 = 35 L ( 35 °chl )
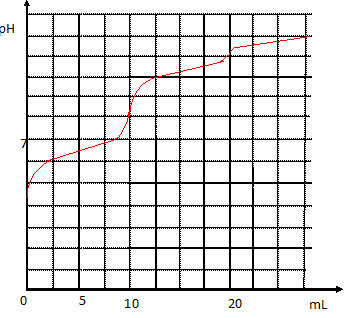
Principe de la manipulation : Les ions hypochlorite ClO- aq réagissent avec les ions arsénite AsO2- aq en excès selon : ClO- aq +AsO2- aq +H2O(l) = Cl-aq + 2H+aq +AsO43- aq (1) L'excès d'ions arsénite est alors titré par une solution de diiode selon : I2 aq + AsO2- aq +2H2O(l) =2 I-aq+ 4H+aq ++AsO43- aq (2) Réactifs et solutions à disposition : Hydrogénocarbonate de sodium solide HCO3Na (s) ; solution commerciale d'eau de Javel à 9,6 % en chlore actif. Solution d'arsénite de sodium AsO2- aq +Na+aq de concentration c1 = 0,05 mol/L. Solution de diiode de concentration c1 =5,00 10-2 mol/L ; empois d'amidon. Protocole opératoire : Dans un premier temps, on place un volume V1 = 10,0 mL de la solution d'ions arsénite de concentration c1 inconnue dans un bécher, on y ajoute 40 mL d'eau, 0,5 g d'hydrogénocarbonate de sodium solide et un peu d'empois d'amidon. D'une burette, on doit verser VE1=9,6 mL d'une solution de diiode pour percevoir la coloration bleutée persistante. Dans un second temps, on réalise une dilution au 1/20 de la solution d'eau de Javel commerciale. On appelle S la solution diluée ainsi préparée. On prélève 10,0 mL de la solution S à laquelle on ajoute 40 mL d'eau, 25,0 mL de la solution d'ion arsénite préalablement dosée, 0,5 g d'hydrogénocarbonate de sodium solide et un peu d'empois d'amidon. Pour percevoir la coloration bleutée, il a fallu verser VE2=8,6 mL d'une solution de diiode Préparation des solutions : Pour quelle raison doit-on ajouter des ions iodure en excès lorsque l'on souhaite préparer une solution aqueuse de diiode au laboratoire ? On accroît fortement la solubilité de I2 dans l’eau en ajoutant de l’iodure de potassium KI en raison de l’existence d’un équilibre de complexation : I2 + I- = I3- ; Kf = 102,9. Toutes les molécules de diiode passent dans la phase aqueuse sous forme d'ion I3-. Indiquer la méthode ( verrerie, précautions à prendre) permettant d'obtenir 200 mL d'une solution d'eau de Javel diluée au 1/20 de la solution commerciale. Port de gant, blouse et lunette. Prélever 20,0 mL de solution commerciale à l'aide d'une pipette jaugée + pipeteur ; placer dans une fiole jaugée de 200 mL contenant 1/3 d'eau distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée ; bouger, agiter pour rendre homogène. Propriétés d'une solution d'ions hydrogénocarbonate : En solution aqueuse, le dioxyde de carbone dissout CO2 aq a des propriétés d'un diacide que l'on notera H2CO3 aq appelé acide carbonique. On dose 10,0 mL d'une solution aqueuse d'acide carbonique de concentration 0,100 mol/L par de la soude de même concentration. On donne la simulation de la courbe de dosage pH métrique :
Quelle est l'équation chimique de la réaction support du titrage pour un volume de soude versé compris entre 0 et 10 mL Calculer sa constante d'équilibre et conclure. On donne pKa( H2CO3 aq / HCO3-aq) = 6,4. H2CO3 aq + HO-aq = HCO3-aq+ H2O(l) ; K = [HCO3-aq] / ([H2CO3 aq ][HO-aq] ) K =[HCO3-aq][H3O+aq] / ([H2CO3 aq ][HO-aq] [H3O+aq] ) = Ka / 10-14 = 10-6,4 /10-14 =107,6. Cette valeur est très grande, la réactuion est totale ; étant de plus rapide, elle peut servir de support à un titrage.
A la demi équivalence de ce dosage acide faible base forte, les quantités de matière d'ion HCO3-aq et de H2CO3 aq sont égales : en conséquence le pH est égal au pKa du couple acide / base H2CO3 aq / HCO3-aq). Pour quelle raison n'observe t-on pas de saut de pH significatif pour un volume ajouté égal à 20 mL ? On donne pKa( HCO3-aq /CO32-aq) = 10,3. Le pH avant la seconde équivalence est proche de 10,5 ; le pH de la seconde équivalence sera voisin de 11,5 à 12 ; or en tenant compte de la concentration de la soude et de la dilution, le pH final sera proche de 12 : en conséquence un saut de pH important ne peut pas exister. Justifier que le pH en V = 10,0 mL correspond à celui d'une solution d'ions hydrogénocarbonate de concentration 5,00 10-2 mol/L. La réaction support du titrage est totale ; à l'équivalence les quantités de matière d'ion hydroxyde et d'acide carbonique sont en proportions stoechiométriques : donc n(HO-aq ajouté )= n(HCO3-aq) = 10,0 10-3*0,100 = 1,00 10-3 mol dans 20 10-3 L de solution. [HCO3-aq] =1,00 10-3 /20 10-3 =5,00 10-2 mol/L. Indiquer les 3 propriétés d'une solution tampon. Une solution tampon fixe le pH d'une solution a une valeur bien déterminée. Une solution tampon modère les variations de pH suite : à l'ajout modéré d'un acide fort ou d'une base forte, suite à une dilution modérée. Une solution aqueuse d'ions hydrogénocarbonate peut-elle être utilisée comme une solution tampon au laboratoire ? Une solution tampon doit contenir les deux espèces d'un couple acide / base ; les quantités de matière de des deux espèces doivent être pratiquement identiques pour avoir un pouvoir tampon maximum. Le couple acide / base (H2CO3 aq / HCO3-aq) contribue à stabiliser le pH du sang et de nombreux autres liquides biologiques. Une solution aqueuse d'hydrogénocarbonate de sodium ne constitue donc pas à elle seule, une solution tampon.
A l'équivalence la quantité de matière de diiode est égale à celle d'ion arsénite d'après (2) : C2VE1 = V1 C1. C1 = C2VE1 / V1 =5,00 10-2*9,6 / 10,0 =4,8 10-2 mol /L. Calculer la concentration C3 en ion hypochlorite dans la solution S. Quantité de matière initiale en ion arsénite : 25,0 10-3 * 4,8 10-2 =1,20 10-3 mol Quantité de matière d'ion arsénite en excès : C2VE2=5,00 10-2*8,6 10-3 =4,3 10-4 mol Quantité de matière d'ion arsénite ayant réagi avec l'ion hypochlorite : =1,20 10-3 -4,3 10-4 =7,7 10-4 mol. D'après (1) : [ClO-]= 7,7 10-4 /0,010 =7,7 10-2 mol/L. Tenir compte de la dilution : 7,7 10-2 * 20 = 1,54 mol/L. Retrouver le pourcentage en chlore actif dans la solution d'eau de Javel commerciale. Cl2(g) + 2HO-aq --> ClO- aq + Cl- aq +H2O(l). n(Cl2) = n(ClO-) = 1,54 mol dans 1 L soit 1,54 * 71 = 109,3 g de dichlore dans 1 L ( c'est à dire dans 1158 g de solution) 109,3 / 1158*100 = 9,4 % ( écart avec l'indication ~ 2%) Dosage potentiométrique d'une solution d'eau de Javel. Il est possible de doser directement la solution d'eau de Javel diluée S par la solution d'ions arsénite à l'aide d'un montage potentiométrique. On prélève alors 10,0 mL de la solution S que l'on place dans un bécher dans lequel on ajoute 40 mL d'eau et 0,5 g d'ions hydrogénocarbonate. La solution titrante d'ions arsénite est placée dans la burette. Indiquer la nature des électrodes devant être utilisées pour ce titrage. Une électrode de référence ( ECS) et une électrode indicatrice métallique ( Pt) de mesure sont plongées dans la solution. On mesure la ddp à l'aide d'un voltmètre de grande résistance ( l'intensité est voisine de zéro). Quelle serait alors la courbe attendue ? Comment repérer l'équivalence ? Avant l'équivalence le couple ClO- aq /Cl2(g) fixe le potentiel : la courbe est un segment de droite presque horizontal vers 1,72 V. Après l'équivalence, le couple AsO43- aq /AsO2-) fixe le potentiel : la courbe est un segment de droite peu incliné vers 0,98 V. A l'équivalence on observe une brutale chute de potentiel de 0,6 à 0,7 V.
|
|||||||||||||
|
c |
|||||||||||||
|
|