|
Le fer et ses ions : dosage potentiométrique, chimie concours Mines 08 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données : NA= 6,02.1023 mol-1 ; premiers elements chimiques (par Z croissant) : H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar, K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn.... La masse molaire du fer est M = 56 g.mol–1 et sa masse volumique est µ =7,9.103 kg.m–3 en phase solide ; sans préjuger de la structure réelle du cristal, en déduire un ordre de grandeur de la distance entre les noyaux. Quantité de matière (mol) dans 1 m3 de fer solide : 7,9.106 /56 =1,41 105 moles. Nombre d'atomes de fer : 1,41 105 *6,02.1023 =8,49 1028 atomes. Soit [8,49 1028 ]1/3 atomes par mètre ; distance entre deux atomes : 1 / [8,49 1028 ]1/3 = 2,3 10-10 m. Le fer est un métal de transition de numéro atomique Z = 26. Déterminer sa configuration électronique puis sa position dans la classification périodique des éléments. 1s2 2s2 2p6 3s2 3p6 4s2 3d6. ( 4è période et 8è colonne ). Par analyse du spectre d’émission, on détecte dans la couronne solaire des ions Fe13+ (ce qui témoigne d’une température de l’ordre de 106 K !) ; quel est l’élément dont l’atome est isoélectronique de cet ion exotique ? Entre cet atome et l’ion Fe13+, lequel présente le plus grand rayon (à justifier) ? Elément de numéro atomique Z = 13, aluminium. Le noyau de l'atome de fer compte 26 protons positifs, celui de l'aluminium compte 13 protons : l'attraction entre les électrons et le noyau de l'ion Fe13+ est bien plus grande que l'attraction entre le noyau de l'aluminium et ces électrons : l'ion Fe13+ est plus petit que l'atome d'aluminium. interpréter ce
fait en relation avec les structures
électroniques de valence des cations
obtenus. Structure
électronique de l'ion Fe2+ :
1s2 2s2 2p6
3s2 3p6 3d6. Structure
électronique de l'ion Cr2+ :
1s2 2s2 2p6
3s2 3p6 3d4. Structure
électronique de l'ion Mn2+ :
1s2 2s2 2p6
3s2 3p6
3d5. Dans ce dernier cas la couche 3 d, à demi
complète, est stabilisée. Règle de Hund : quand on a
plusieurs O.A de même énergie ( p,
d...), il faut occuper le maximum d'OA avec des
spins parallèles. e = 1,6 10-19 C; E°1(Ce4+/Ce3+) = 1,72 V ; E°1(Fe3+/Fe2+) = 0,77 V. On envisage le dosage potentiométrique des ions fer(II) par des ions cérium(IV) (ions ferreux et ions cériques) : écrire la réaction de dosage. Quelle est la quantité d’électricité échangée pour un avancement de 1 mole ? Ce4+ + e- = Ce3+ ; Fe2+ = Fe3+ + e- d'où : Ce4+ + Fe2+ = Fe3+ +Ce3+. Constante d'équilibre K = [Fe3+]éq[Ce3+]éq/ ([Ce4+]éqFe2]éq) Une mole d'électron est échangée par mole d'ion fer (II) soit 1F = 9,6 104 C. Si l’on prépare un mélange initialement équimolaire en ions ferreux et cériques, quelles relations simples aura-t-on entre les concentrations à l’équilibre des ions fer(II) et cérium(IV) d’une part, fer(III) et cérium(III) d’autre part ? En déduire la valeur du potentiel d’équilibre Eéq. de cette solution, en fonction de E°1 et E°2. On raisonne sur un volume de 1 L.
E1 = E°1 + 0,06 log ([Ce4+] / [Ce3+]) ; E2 = E°2 + 0,06 log ([Fe3+] / [Fe2]) ; E1 éq = E°1 + 0,06 log ([Ce4+]éq / [Ce3+]éq) ; E2 éq = E°2 + 0,06 log ([Fe3+]éq / [Fe2]éq) ; E1 éq =E2 éq ; E°1 + 0,06 log ([Ce4+]éq / [Ce3+]éq) = E°2 + 0,06 log ([Fe3+]éq / [Fe2]éq) ; E°2 -E°1 = 0,06 log K ; log K = (1,72-0,77) / 0,06 =15,83 ; K = 6,8 1015. K est très grande, la réaction est totale, quantitative. K = [x/(1-x)]2 ; x/(1-x) = K½ =8,25 107. E1 éq = E°1 + 0,06 log ([Ce4+]éq / [Ce3+]éq) = 1,72 +0,06 log [(1-x)/x] = 1,72 -0,06 log 8,25 107 = 1,25 V.
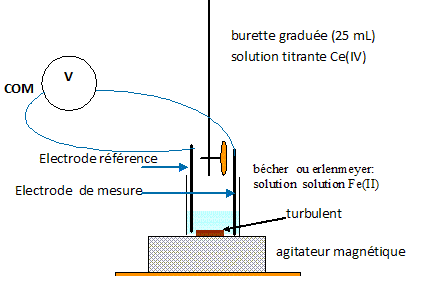
Schématiser le dispositif décrit en identifiant clairement les électrodes et la tension mesurée.
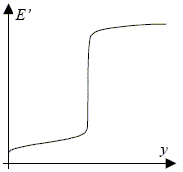
Sans nouveaux calculs, donner la valeur du potentiel E’ pour y = 1. En déduire la proportion d’ions ferreux résiduels (non dosés) lorsque y = 1, sous la forme [Fe2+]éq / [Fe2+]0 ; conclure. La quantité de matière d'ion cerrique est égale à la quantité de matière initiale d'ion der (II) : y=1 correspond au point équivalent. E1 éq =1,25 V par rapport à l'électrode à hydrogène ; E' = 1,25-0,25 = 1,0 V par rapport à l'électrode de référence. x/(1-x) = K½ =8,25 107~ 108 soit (1-x) / x = 10-8 ; [Fe2+]éq / [Fe2+]0 = 10-8. La réaction est totale. La courbe obtenue permet un dosage prrècis car le saut de potentiel est important.
En fait, on mesure E'(y = 1/2) = 0,42 V. Pour interpréter cet écart à la théorie, sachant qu’on travaille en milieu sulfurique et qu’on a utilisé des sulfates (ferreux et cérique), on envisage la formation d’un ion complexe Fe(SO4)+ entre le fer(III) et l’ion sulfate en excès.( remarque : l’ion sulfate complexe aussi les ions fer(II), mais beaucoup plus faiblement et on négligera ce phénomène). On donne pour ce complexe : pKd = 3,85 ; d’autre part, lorsque y = 1/2, la concentration en ions sulfates est voisine de 10–2 mol.L–1. Exprimer E'(y = 1/2) en tenant compte de la complexation du fer(III) et montrer qu’on retrouve effectivement la valeur mesurée. A la demi équivalence [Fe2+]½=[Fe3+]½+[Fe(SO4)+]½ = [Fe3+]½( 1+[Fe(SO4)+]½ / [Fe3+]½) Or Fe(SO4)+ =Fe3+ +SO42- avec Kd =[Fe3+][SO42-] / [Fe(SO4)+ ] par suite [Fe2+]½= [Fe3+]½( 1+ [SO42-] ½/Kd ) = [Fe3+]½(1+0,01/10-3,85 ) =71,8 ;[Fe3+]½ /[Fe2+]½=1/71,8 =0,0139. E2 ( y = 0,5) = E°2 + 0,06 log ([Fe3+]½ / [Fe2]½) = 0,77 + 0,06 log 0,0139 =0,66V soit 0,66-0,25 = 0,41 V par rapport à
l'électrode de référence.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|