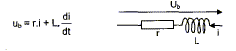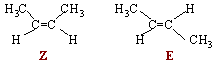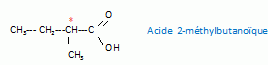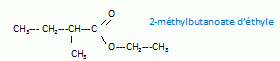Acide
base.
On
donne : ion ammonium /
ammoniac NH4+
/ NH3 Ka = 6,3 10-10 ou pKa = 9,2 à 25°C.
Zones de virages d'indicateurs
colorés : hélianthine : (rouge) 2,4 - 4,4 ( jaune)
Rouge de méthyle : (rouge) 4,2
- 6,2 (jaune)
Bleu de bromothymol : (jaune)
6,0 - 7,6 ( bleu)
Phénolphtaléine : ( incolore)
8,2 - 9,9 (rose).
On considère une
solution S1 de chlorure d'ammonium à la
concentration c1 = 0,20 mol/L et une solution S2
d'ammoniac à la concentration c2 = 0,12 mol/L.
Partie
1.
Tracer le diagramme de
prédominance du couple de l'ion ammonium.
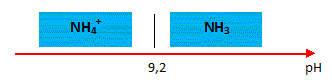
Le pH de la solution S2
vaut pH = 11,1.
En déduire l'espèce
prédominante dans cette solution.
A pH
supérieur à pKa, la forme base NH3
du couple prédomine.
Déterminer
la concentration en ion oxonium de cette solution.
[H3O+] = 10-pH = 10-11,1 = 7,94 10-12 mol/L.
Le pH de la solution S1
vaut pH = 4,95.
En déduire l'espèce
prédominante dans cette solution.
A pH inférieur à pKa,
la forme acide NH4+ du couple prédomine.
Partie 2.
On mélange 28,0 mL de solution S1 et 12,0 mL de solution S2.
Déterminer
le rapport [NH3] / [NH4+]
à l'équilibre à 25 °C.
Quantité de matière (mol) = volume (L) fois
concentration ( mol/L)
Quantité de matière initiale : n0 (NH3)=12 *0,12 = 1,44 mmol ; [NH3] = 1,44 / (28+12) = 0,036 mol/L.
n0
(NH4+)=28 *0,20 = 5,6 mmol ; [NH4+] =5,6 / (28+12) =0,14 mol/L.
[NH3] / [NH4+] =
0,036/0,14 = 0,257.
Donner la
valeur du pH de la solution.
pH = pKa + log ( [NH3] / [NH4+] )
=9,2 + log 0,257 =8,6.
Quelle est la nature de la solution
obtenue ? Quelles sont ses
propriétés ?
Le pH de la solution est assez
proche de la valeur du pKa : la solution possède un pouvoir
tampon.
Un solution tampon modère les variations de pH suite à l'ajout
d'une petite quantité de base forte ou d'acide fort.
Le pH d'une solution tampon ne varie pas
par dilution.
|
|
Partie
3.
Rappeller
les précautions à prendre lors de l'utilation d'acide
chlorhydrique concentré.
Port de blouse, gants et lunettes de protection.
Dans un becher on introduit 20,0 mL de la solution S2. Avec quel instrument
de verrerie prélève t-on les 20,0 mL ?
20,0 : 3 chiffres significatifs. Un volume précis est prélever à
l'aide d'une pipette jaugée.
Comment
l'acide chlorhydrique est-il produit dans l'industrie ?
Le dichlore gazeux est combiné avec le dihydrogène.
La majeure partie de l'acide chlorhydrique est obtenu dans des
installations produisant des composés organiques chlorés.
|
A l'aide d'une burette, on ajoute dans le becher de
l'acide chlorhydrique à 0,15 mol/L.
Ecriver l'équation de la
réaction qui se produit.
NH3 aq + H3O+
aq = NH4+ aq + H2O (l).
Exprimer puis calculer la
constante d'équilibre K associée à la réaction. Conclure.
K = [NH4+] / ([NH3] [H3O+]
).
Or Ka = ([NH3] [H3O+] / [NH4+]
d'où K = 1 / Ka = 1 / 6,3 10-10 = 1,6 109.
K est très grand : la réaction est totale.
On s'intéresse à
l'équivalence de ce dosage.
Définir
l'équivalence et déterminer le volume de solution titrante à
verser pour l'atteindre.
A l'équivalence les quantités de matière des réactifs mis en présence
sont en proportions stoechiométriques. Avant l'équivalence l'un des
réactifs est en excès, après l'équivalence, l'autre réactif est en
excès.
Quantité de matière d'ammoniac : 12 * 0,12 = 1,44 mmol
Quantité de matière d'acide : V *0,15 = 1,44 ; V = 1,44 / 0,15 =9,6 mL.
On repère l'équivalence à l'aide d'un indicateur coloré. Lequel choisir ;
justifier.
A l'équivalence on a une solution de chlorure d'ammonium : l'ion
ammonium est un acide, donc le pH de la solution est inférieur à
7.
La zone de virage de l'indicateur coloré doit contenir le pH du point
équivalent : donc Rouge de méthyle : (rouge) 4,2 - 6,2
(jaune).
Résistance d'une bobine réelle.
|
On désire vérifier la résistance r
d'une bobine réelle d'inductance L= 250 mH
modélisée par :
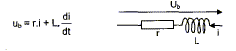
A- En régime
permanent :
On réalise un circuit comportant un
générateur de tension continue de fem E= 6,0
V, de résistance interne négligeable, un
ampèremètre numérique, un
voltmètre numérique, des fils de connexion et
la bobine étudiée.
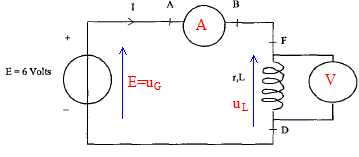
- Compléter le schéma ci-dessous en
indiquant la position de l'ampèremètre, du
voltmètre. Faire figurer la tension
uG=E aux bornes du générateur,
uB, tension aux bornes de la bobine. La
tension aux bornes de l'ampèremètre est
négligeable.
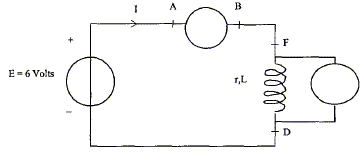
Les mesures des appareils donnent u B=5,95
V et I= 410 mA. En déduire la résistance r
de la bobine en justifiant la démarche.
En régime permanent l'intensité
I0 est constante et dI0/dt est nulle ;
la tension aux bornes de la bobine est
uL=rI0
uL=rI0 ; r = uL
/I0 = 5,95 / 0,410 = 14,5 W.
|
|
|
Isomérie plane, stéréoisomérie.
Qu'appelle t-on stéréoisomères ?
Molécules, possédant la même formule semi-développée, mais dont l'arrangement dans l'espace est différent.
les stéréoisomères peuvent être regroupés en deux catégorie. Lesquels ? Donner des exemples.
Diastéréoisomères : le passage d'une configuration à une
autre nécessite la rupture d'une liaison
chimique .
A température
ambiante, la rotation autour d'une liaison double
carbone carbone n'est pas possible. Le
Z
but-2-ène et le
E
but-2-ène sont des
diastéréoisomères, aux
propriétés chimiques et physiques
différentes. Ces 2 configurations sont
séparables.
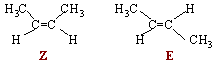
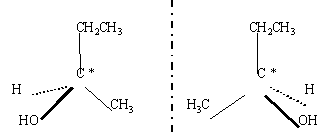
Enantiomères : ce sont 2 isomères de configuration,
images l'un de l'autre dans un miroir. Deux
énantiomères ne différent que
par leur propriétés optiques; ils
sont séparables
|
|
|
Identification d'un composé organique.
Le composé A est un ester de masse
molaire 130 g/mol. L'analyse élémentaire de A donne les
pourcentages massiques des éléments carbone, oxygène et
hydrogène. C : 64,6 % ; H : 10,8 % ; O : 24,6 %.
Déterminer la formule brute de A.
Formule brute : CxHyOz avec x, y, z entiers.12 x / 64,6 = 130 / 100 = 1,3 ; x = 1,3*64,6 / 12 = 7
y / 10,8 = 1,3 ; y = 10,8*1,3 =14 ;
16 z / 24,6 = 1,3 ; z = 1,3*24,6/16 = 2
C7H14O2.
On fait réagir à chaud l'ester A avec une solution aqueuse de potasse ( K+ + HO- ). Cette réaction donne de l'éthanol et un anion organique B.
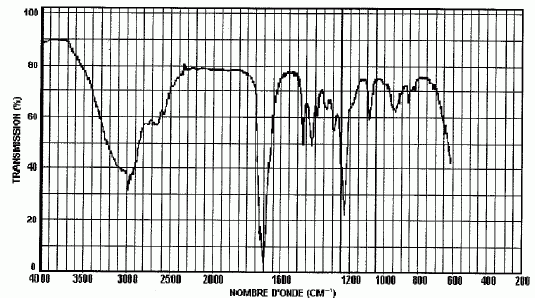
l'action d'un acide fort avec B donne un composé neutre B'. Le spectre infrarouge de B' est donnée ci-dessous.
Donner la formule brute de B et B' ; justifier.
Il s'agit de la saponification d'un ester donnant un alcool et un ion carboxylate (B) :
C7H14O2 + HO- = C5H9O2- (B) + C2H6O( éthanol)
suivi de : C5H9O2- (B) + H3O+ = C5H10O2 (B') + H2O
Identifier les bandes qui caractérisent la fonction organique portée par B'.
Il s'agit de la fonction acide carboxylique.
Large bande vers 3000 cm-1 : groupe OH lié par liaison hydrogène.
Pic intense vers 1700 cm-1 : groupe C=O.
Ecrire les formules semi-développées et donner les noms des isomères en chaîne de B'.
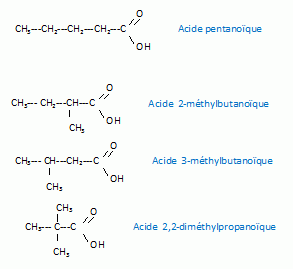
B' est chirale. Identifier B'.
La présence d'un carbone asymétrique conduit à une molécule chirale :
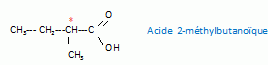
Ecrire la frormule semi développée de A et nommer A.
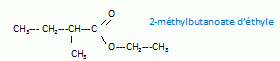
|