|
Préparateur en chimie : concours ITRF Toulouse 2008. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
diazote N2 ;
dioxygène O2 ; gaz rare : argon
Ar. Combien de g de soude
en pastille faut-il ajouter à 80 g d'eau
distillée pour obtenir une solution de NaOH
à 20 %
? On note m la masse de
soude ajoutée ; masse de la solution 80 +
m pourcentage massique de
soude : m/ (80+m) = 0,20 ; m =
(80+m)*0,2 m = 16 + 0,2 m ; m = 16 /
0,8 = 20
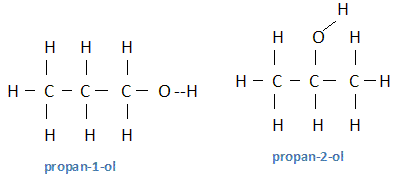
g. C : 60 % ; H : 13,33 % ; O : 26,67 %. On donne : C : 12 ; H : 1,0 ; O : 16 g/mol. Quelle est la formule brute du produit ? Formule brute : CxHyOz avec x, y, z entiers. Masse molaire M = 12x + y +16z = 60 Proportion de carbone C : 12x / 60 = 0,6 ; x = 0,6*60 / 12 =3 Proportion d'élement hydrogène : y/60 = 0,1333 ; y = 60*0,1333 = 8 Proportion d'élément oxygène : 16z/60 = 0,2667 ; z = 60*0,2667/16 =1 C3H8O. Quelles sont les formules développées possibles et leurs noms .
2 CuO + Cu2S = 4 Cu + SO2. C3H8 + 5 O2 = 3 CO2 + 4 H2O. Al + 3 HCl = AlCl3 +1,5 H2. 2 FeO + C = 2 Fe + CO2. Cu + ½ O2 + H2SO4 = CuSO4 + H2O. MnO4- + 8 H+ +5 e- = Mn2+ + 4 H2O. Définir la notion de pH. Le pH ( "potentiel hydrogène" ) est défini à partir de la concentration en ion oxonium, exprimée en mol/L, par la relation pH = - log [H3O+]. L'échelle usuelle des pH va de 0 à 14. Le pH mesure l'acidité ou la basicité d'un milieu ou d'une solution.
KOH ( basique) ; HCl ( acide ) ; NaCl ( neutre ) ; NH4Cl ( légèrement acide ) ; HNO3 (acide) ; CH3COOH ( acide). Donner la signification des six pictogrammes ci-dessous.
1 : laser ; 2 : comburant ; 3: corrosif ; 4 : danger pour l'environnement ; 5 : champ magnétique ; 6 : inflammable Quel est le pictogramme " danger"
symbolysant la cause du décès de Marie Curie ?
" Suite à une trop grande exposition aux éléments radioactifs, elle est atteinte d’une leucémie." Citez les 4 classes de feux et quel type d'extincteur il faut utiliser pour chaque classe. Les feux sont classés en 4 classes: A : feux de
solides ; B : feux de liquides ; C : feux de gaz ; D : feux
de métaux. On y ajoute les feux d'origine
électrique E.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||