|
Emissions de rayons X induite par particules chargées ou PIXE concours général 2009.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
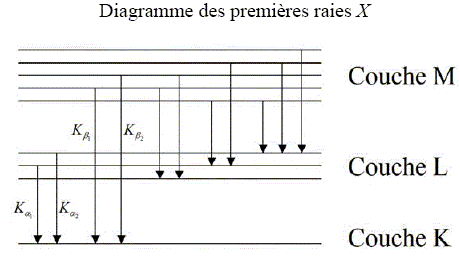
La méthode PIXE correspond au cas où les produits secondaires sont des photons appartenant au domaine des rayons X. Cette méthode fut particulièrement adaptée à l’étude de bijoux de l’époque mérovingienne. Principe : Il s’agit de capter les rayons X émis par l’objet de musée lorsqu’il est placé dans le faisceau d’un petit accélérateur de particules. En effet, stimulés par les particules du faisceau, les atomes de la matière émettent un rayonnement X caractéristique de chaque élément. Sans prélèvement ni dommage, et en quelques minutes, la méthode PIXE délivre la concentration de tous les éléments compris entre le sodium et l’uranium. Le mécanisme de cette technique est un processus atomique en trois étapes : - En pénétrant dans l’objet à analyser, une particule du faisceau éjecte un électron proche du noyau d’un atome. - L’atome ne reste pas dans cet état instable et excité. Le trou laissé est aussitôt comblé par un électron d’une orbite plus extérieure. - Lors de ce réarrangement, l’atome émet un rayon X pour libérer son excès d’énergie. L’énergie du rayonnement X est caractéristique de chaque élément chimique. Il ne reste plus qu’à détecter ces rayons X caractéristiques et à en déduire la composition de l’objet. Pourquoi dit-on de l’atome qu’il est dans un état instable lors de la 2ème étape ? L'atome ionisé, après l'étape 1, ne se trouve pas dans son état fondamental de moindre énergie. Certains électrons, plus externes, n'occupent pas les niveaux d'énergie les plus faibles. Pourquoi chaque rayon X émis est-il caractéristique d’un unique élément ? Les niveaux d'énergie de l'atome étant quantifiés, le spectre de raies d'émission est la signature d'un atome. En effet, lors de fouilles effectuées sous la basilique Saint Denis au nord de Paris, diverses parures furent mises à jour. L’origine des matériaux employés dans ces bijoux ainsi que les techniques de fabrication étaient imparfaitement connues. Typiquement, c'est un trou
dans la couche K qui est comblé par un
électron de la couche L,
immédiatement supérieure. Comme les
niveaux d'énergie des électrons sont
liés au numéro atomique de l'atome,
la technique PIXE donne une une "analyse en Z " de
la matiere. On utilise les
règles suivantes pour nommer les raies X
correspondantes : - la raie adopte le nom de
la couche "d'atterrissage" de l'électron :
par exemple la transition couche L -->couche K
donne une raie K. - un indice grec identifie
la couche dont provient l'electron : par exemple,
la transition couche M -->couche L se nomme
La. Les raies K sont utilisées pour les éléments légers à moyens, tandis que les raies L sont mises à profit pour les éléments moyens à lourds. Les raies M, quant à elles, ne sont pas utilisées pour doser les éléments car elles sont mal modélisées.
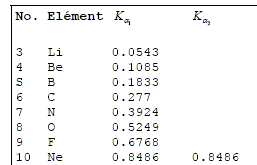
Calculer en Joules puis en électronvolts la gamme de détection de l’appareil en termes d’énergie. E = hc / l avec h = 6,626 10-34 Js ; c = 2,998 108 m/s Emax = hc / lmax = 6,626 10-34 *2,998 108 / 3,10 10-11 =6,408 10-15 J ~ 6,41 10-15 J. Emin = 6,408 10-15 / 1,602 10-19 =4,00 104 eV. Emin = hc / lmin = 6,626 10-34 *2,998 108 / 1,24 10-9 =1,602 10-16 J ~ 1,61 10-16 J. Emin =1,602 10-16 / 1,602 10-19 =1,00 103 eV. Consulter la table d’énergie des raies K et expliquer pourquoi il n’est pas possible de détecter des éléments comme le carbone, l’oxygène ou l’azote. Les énergies données
dans la table ci-contre sont en keV. Les énergies des raies Ka des éléments oxygène, carbone et azote sont inférieures à 1 keV, donc en dehord des limites de détection de l'appareil. Déduire des réponses aux questions précédentes, les atomes détectables par cette méthode. Les énergies des raies Ka, Kß permettent d'identifier les éléments allant du Na au Nd. Les énergies des raies La, Lß , Lg permettent d'identifier les éléments allant du Cu à U. Les énergie correspondantes se situent dans la gamme (1 keV à 40 keV) de détection de l'appareil.
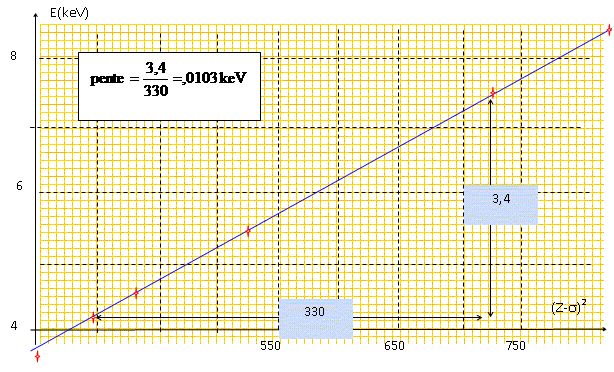
Moseley, physicien anglais, montra en 1913 que l'on pouvait représenter la fréquence des raies homologues pour chacun des éléments par une formule du type : n = a (Z-s)2. Dans cette égalité, a et s sont des constantes, Z le numéro atomique et n la fréquence. Quelle relation lie l'énergie et la fréquence ? E = h n En déduire la relation entre E et (Z-s). E = h a (Z-s)2. A l'aide de la table
d'énergie des raies Ka1
des éléments situés dans l'annexe,
tracer pour les éléments compris entre le
calcium et le zinc le graphe E=f (Z-s)2
, sachant que pour cette gamme de numéro atomique, la
constante s
vaut 1,13. Quelle est la nature de la courbe obtenue ? Déterminer son équation.
Droite d'équation E = 0,0103 (Z-s)2 avec E en keV.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|