|
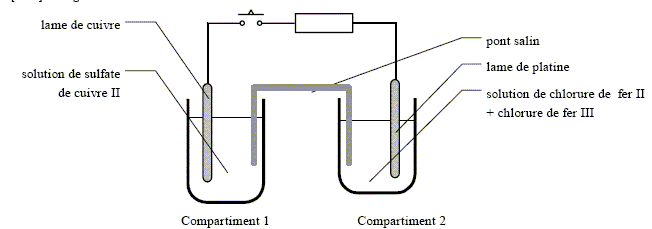
Fonctionnement d'une pile concours ENI GEIPI 2009.
|
|||||||
|
|||||||
|
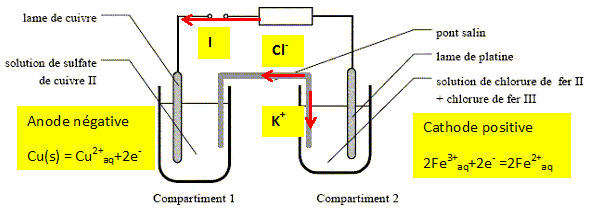
Ecrire l’équation-bilan de cette réaction. Cu(s) + 2Fe3+aq = 2Fe2+ aq + Cu2+aq. Préciser parmi les espèces chimiques présentes celles qui jouent le rôle d’oxydant / le rôle de réducteur lors de la réaction. Le cuivre Cu(s) s'oxyde en ion Cu2+aqsuivant : Cu(s) = Cu2+aq + 2e-. La cuivre Cu(s) joue le rôle de réducteur. Fe3+aq se réduit en Fe2+ aq suivant : 2 Fe3+aq + 2e- = 2Fe2+ aq Fe3+aq joue le rôle d'oxydant. Donner
l’expression littérale de K en fonction
des concentrations des réactants à
l’équilibre. K = [Fe2+
aq]2[Cu2+aq]
/
[Fe3+aq]2. • compartiment 1 : solution de sulfate de cuivre : [CuSO4] = 0,01 mol.L-1. • compartiment 2 : solution de chlorure de fer II [FeCl2] = 0,01 mol.L-1 + chlorure de fer III [FeCl3] = 0,01 mol.L-1. Le pont salin est quant à lui constitué d’une solution gélifiée de chlorure de potassium de concentration massique [KCl] = 75 g L-1.
Calculer la concentration molaire de la solution du pont salin. M(K) =39,1 g/mol ; M(Cl) = 35,5 g/mol. M(KCl )= 39,1 +35,5 =74,6 g/mol Concentration molaire = concentration massique / masse molaire = 75/ 74,6 =1,0 mol/L. Déterminer le quotient réactionnel Q du système au début de l’expérience (interrupteur ouvert). Q = [Fe2+ aq]i2[Cu2+aq]i / [Fe3+aq]i2 = 0,012*0,01 / 0,012 = 0,01. Q << K donc évolution spontanée dans le sens direct.
On ferme l’interrupteur. Compléter le schéma en précisant : - la polarité + / - des deux électrodes - s’il existe, le sens du courant dans le conducteur ohmique - s’il existe, le sens du courant dans le pont salin - la nature des électrodes : anode ou cathode : compartiment 1 - compartiment 2 - les réactions électrochimiques : compartiment 1 - compartiment 2
|
|||||||
|
c |
|||||||
|
|