|
Cinétique, oxydoréduction, absorbance, estérification concours Fesic 2009 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cette transformation est modélisée par l'équation chimique : S2O82-aq + 2 I-aq = I2 aq + 2SO42-aq. A- Les ions I-aq sont oxydants. Faux. couple oxydant réducteur I2 aq / I-aq : I-aq est un réducteur qui s'oxyde. B- La solution devient brune au fur et à mesure que la réaction progresse. Vrai. Le diiode ( l'un des produits) est la seule espèce colorée ( jaune brune en solution aqueuse). On réalise trois expériences à volume constant, pour différentes concentrations initiales en réactifs et à différentes températures.
Les quantités de matière initiales des réactifs sont identiques ; la température plus élevée en 3 permet d'atteindre plus rapidement l'état final sans en modifier la composition. D- La concentration finale du diiode dans l'expérience 2 est 1,0 10-3 mol/L. Faux. On travaille avec 1 L de solution :
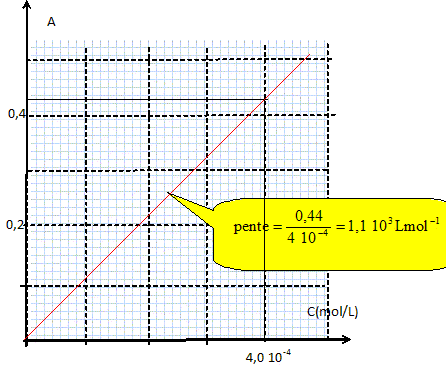
Si I-aq est en défaut : 1,0 10-3 -2xmax = 0 ; xmax =5,0 10-4 mol [ I2 aq]oo =5,0 10-4 mol /L. On plonge une lame de zinc dans une solution aqueuse d'ion triodure I3-aq. La transformation qui se produit est modélisée par l'équation : Zn(s) + I3-aq = Zn2+aq + 3I-aq. Sachant que l'espèce I3-aq est coloré on peut effectuer le suivi spectrophotométrique de cette réaction. Préalablement aux mesures, on emploie des solutions de concentrations connues d'ions I3-aq, dont on mesure l'absorbance.
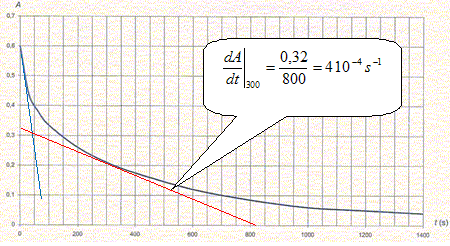
On utilise la longueur d'onde pour laquelle l'absorption est maximale. B- Le coefficient directeur de la courbe d'étalonnage est 1,1 S.I. Vrai. 1,1 103 L mol-1 = 1,1 m3 mol-1. A = 1,1 C avec C en mol m-3. On mesure l'absorbance A de la solution d'ions triodure dans laquelle on a plongé la lame de zinc. L'évolution de l'absorbance au cours du temps est donnée ci-dessous :
C- à la date t=0, la vitesse de la réaction est nulle. Faux. La tangente à l'origine n'est pas horizontale : dA/dt est différent de zéro ; L'absorbance étant proportionnelle à la concentration, la vitesse volumique est proportionnelle à dA/dt. D- à la date t=300, la vitesse volumique de la réaction a pour ordre de grandeur 10-2 m3mol-1.s-1. Faux vitesse v(t=300 s) = dC/dt avec A = 1,1 C ; dA/dt = 1,1 dC/dt v(t=300 s) =1/1,1 dA/dt = 4 10-4 / 1,1 ~ 10-4 m3mol-1.s-1.
On étudie en milieu acide à 20 °C la cinétique de la réaction de l'eau oxygénée H2O2 aq avec les ions iodure I-aq. Il s'agit d'une transformation totale qui produit du diiode et de l'eau. L'acide est en excès. Les concentrations initiales des réactifs sont : [H2O2]0=0,1 mol/L ; [ I-]0=0,4 mol/L.
A- Les ions H3O+ sont des réactifs dans cette transformation chimique. Vrai. H2O2 aq +2 I-aq + 2 H+aq = I2 aq + 2H2O (l) B- Le peroxyde d'hydrogène H2O2 est le réactif limitant. Vrai. On travaille avec 1 L de solution :
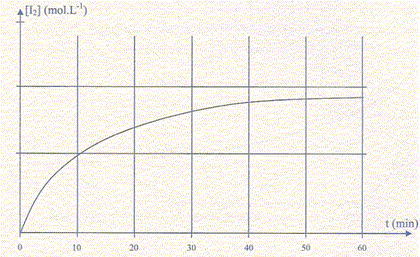
Si I-aq est en défaut : 0,4-2xmax = 0 soit xmax = 0,2 mol C- La vitesse volumique de réaction peut s'écrire v = -2 d[I-]/dt, si x = nI2 formé. Faux. v = 1/V dx/dt avec [I-] = (0,4-2x)/V ; d [I-] /dt = -2/V dx/dt = - 2 v ; v = -0,5 d [I-] /dt. D- La courbe [I2]=f(t) tend asymptotiquement vers 0,2 mol/L . Faux. n(I2) finale = 0,1 mol.
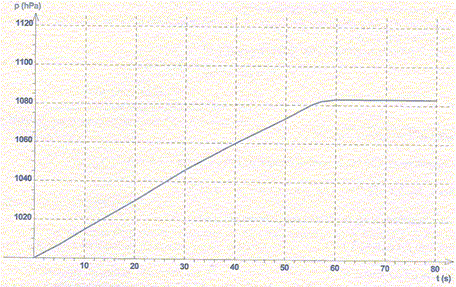
La réaction a lieu dans une enceinte fermée thermostatée. La cinétique est suivie par mesure de la pression totale dans l'enceinte. La courbe p = f(t) est donnée ci-dessous. La valeur de la pression totale p dans l'enceinte en fin de réaction est égale à 1083 hpa.
Température : 23 °C ; R = 8,3 J K-1 mol-1. A- La pression totale p dans l'enceinte est proportionnelle à la quantité de dihydrogène formé. Faux. ptotale = pinitiale + pdihydrogène. B- La quantité de matière de dihydrogène formé est égale à la quantité de matière de potassium consommé. Faux. 2K(s) + 2H2O(l) = 2K+aq + H2(g) + 2HO-aq. n(H2) = ½n(K) C- La quantité de matière de dihydrogène formé en fin de réaction est 1 mmol. Vrai. M(K) = 39 g/mol ; n(K) = m/M = 78 10-3/39 = 2 10-3 mol = 2 mmol. n(H2) = ½n(K) = 1 mmol. D- Le volume de gaz dans l'enceinte est de 300 cm3. Vrai. Equation des gaz parfaits : PV = nRT avec T = 273+27 = 300 K. Initialement l'enceinte contient de l'air : nair = Pinitiale V / (RT) =105 V / (8,3*300) = 40,16 V. A la fin l'enceinte contient de l'air et du dihydrogène : ntotal =n(H2) +nair = 0,001 +40,16 V. ntotal = Pfinale V / (RT) =1,083 105 V / (8,3*300) =43,5 V 0,001 +40,16 V = 43,5 V ; V ~ 3 10-4 m3 =0,3 L = 300 cm3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|