|
Estérification, oxydoréduction, absorbance, conductimétrie concours Fesic 2008 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
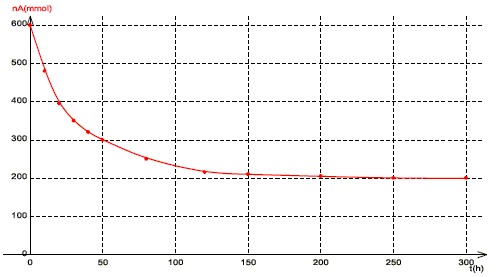
A- Il s’agit d’une réaction d’hydrolyse. Faux. Les réactifs ( état initial) sont l'acide méthanoïque et le pentan-1-ol : il s'agit d'une réaction d'estérification. B- Le produit de la réaction est le méthanoate de pentyle. Vrai. C- Le temps de demi-réaction est égal à 50 heures. Faux. Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
x(t½ )= ½ xf = 200 mmol et nA (t½) = 600-200 = 400 mmol Par lecture sur le graphe, le temps de demi-réaction est proche de 25 heures D- Le taux d’avancement final est égal à 33 %. Faux. xf = 400 mmol ; xmax = 600 mmol ;
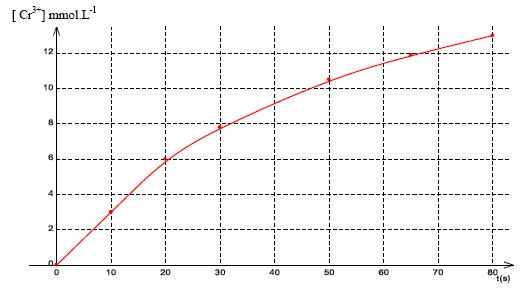
On étudie en fonction du temps l’évolution d’un mélange obtenu à partir de 100 mL de solution aqueuse d’acide oxalique de concentration molaire en soluté apporté 6,00.10-2 mol.L–1 et 100 mL d’une solution acidifiée de dichromate de potassium de concentration molaire en soluté apporté 1,66.10-2 mol.L–1. On obtient la courbe suivante qui représente l’évolution de la concentration molaire en ions chrome (III) en fonction du temps :
A- Le dioxyde de carbone est l'acide conjugué de l'acide oxalique H2C2O4. Faux. Le dioxyde de carbone est l'acide conjugué de l'ion hydrogénocarbonate ( bicarbonate) HCO3-. couple acide / base : CO2 / HCO3-. B- Le mélange initial est dans les proportions stoechiométriques. Faux. réduction de l'oxydant : Cr2O72- + 14 H+ + 6e- --> 2Cr3+ + 7H2O oxydation du réducteur : 3 fois{ C2H2O4 --> 2 CO2 + 2H+ + 2e-} oxydo réduction : Cr2O72- + 14 H+ + 3 C2H2O4 --> 2Cr3+ + 6 CO2 + 6H++ 7H2O Cr2O72- + 8 H+ + 3 C2H2O4 --> 2Cr3+ + 6 CO2 + 7H2O
Si C2H2O4 est le réactif limitant : 6-3xf = 0 ; xf = 2 mmol. C- L'acide oxalique est le réactif limitant. Faux. D- Quand t tend vers l'infini, la courbe tend vers une limite asymptotique d'équation [Cr3+] = 16,6 mmol.L-1. Vrai. n(Cr3+) tend vers 2xf = 2*1,66 = 3,32 mmol dans 200 mL. [Cr3+] = 3,32 / 200 =0,0166 mol /L = 16,6 mmol.L-1.
Soient A et B deux solutions aqueuses ioniques dont les caractéristiques sont dans le tableau ci-dessous :
Données : Couples d’oxydoréduction : I2 /I- ; S2O82- / SO42- A- C’est la formation de diiode qui colore la solution en jaune-orangé. Vrai. B- A l’instant t = 0, l’absorbance est nulle. Vrai. L’absorbance du mélange est A = 0,50 pour une concentration molaire en espèce chimique colorée c = 1,0.10-4 mol.L-1. C- On mesure une absorbance A = 1,0 pour le même mélange mais à une concentration molaire en espèce chimique colorée c/2. Faux. Aux faibles concentrations, absorbance et concentration sont proportionnelles. On mesure une absorbance maximale Amax = 2,0. D- La concentration massique maximale en diiode est égale à 0,10 g.L-1 . Vrai. Masse molaire I : M= 127 g/mol ; M(I2) = 254 g/mol Aux faibles concentrations, absorbance et concentration sont proportionnelles. [I2]max = 4 c = 4,0.10-4 mol.L-1. 4,0.10-4 * 254 = 0,10 g.L-1 .
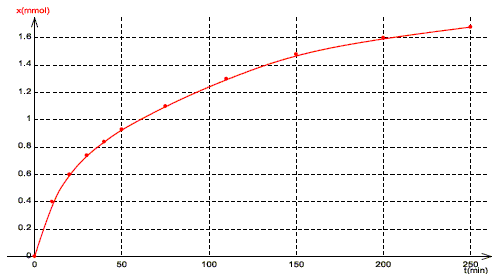
Un acide de Bronsted est susceptible de céder un proton H+ ; or dans la formule de l'ion cyanate, l'élément H ne figure pas. B- L’avancement de la réaction a pour expression : Vrai.
x (mmol) ; V (mL) ; [NH4+ (aq)] =[OCN- (aq)] = x / V mol/L = 103 x/V mol m-3. Conductivité de la solution à la date t : s = lNH4+[NH4+ (aq)]+ lOCN-[OCN- (aq)] = ( lNH4+ +lOCN-) 103 x/V. Conductivité finale de la solution : s max= ( lNH4+ +lOCN-) 103 x max/V.
C- L’avancement maximal xmax est égal à 2,0 mmol. Vrai. D- A la date t = 200 min, le taux d’avancement de la réaction est égal à 80 %. Vrai. lecture graphe à la date t = 200 min : x = 1,6 mmol taux d'avancement final : x / xmax = 1,6/2 = 0,8 ( 80 %).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|