|
Assistant en techniques d'analyse chimique concours CNRS Alsace 2008. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
GC : chromatographie gazeuse. HPLC : chromatographie en phase liquide à haute performance. ICP-AES : spectrométrie d'émission atomique à source plasma. LC-MS : chromatographie liquide couplée à la spectrométrie de masse. IRFT : spectrométrie infrarouge à transformée de Fourier NMR : résonance magnétique nucléaire. MALDI-MS : spectromètre de masse couplé à une source d'ionisation laser assistée par une matrice ESI-MS : ionisation par électronébuliseur - spectrométrie de masse. Spectrométrie de masse. Quelle est la valeur physique mesurée en spectrométrie de masse ? m est la mase en unité de masse atomique et e
la charge électrique exprimée en nombre de charge élémentaire.
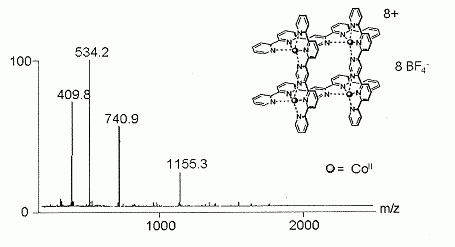
De plus l'examen de la structure indique
une vingtaine de cycle à 6 atomes soit une masse molaire
proche de 20*80 ~ 1600 Da ) Préciser comment l'ionisation du composé est obtenue. L'analyse d'un composé aromatique sur un appareil à spectrométrie de masse à a donné le spectre de fragmentation suivant : 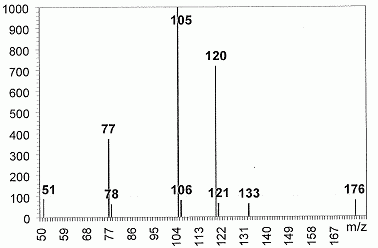 Quel est le pic moléculaire ? C'est le pic le plus à droite. Expliquer l'origine du pic à 105 et du pic à 77. Cations stabilisés par résonance : C6H5+ et C6H5CO+.
On veut doser le cuivre dans un échantillon de poudre de silice par ICP ( émission atomique à plasma ). Pour cela on fait deux prélèvements , un de 3,5 mg, l'autre de 5,6 mg. On leur fait subir une attaque avec 5 mL d'HCl à 12 N plus quelques gouttes d'HF ( acide fluorhydrique). En fin de minéralisation, les solutions sont ajustées à 50 mL. Par ailleurs, on effectue une courbe d'étalonnage à l'aide de concentrations connues. On effectue les mesures des solutions connues et inconnues et on obtient le tableau suivant :
corrosif par les ions acides (H+), il attaque les tissus en surface, toxique par les ions (F-) : la couche superficielle de la peau ou de l'oeil étant détruite par l'acide, ces ions très petits pénétrent en profondeur, attaquant le calcium des os. Comment remédier aux conséquences d'une brûlure à l'acide fluorhydrique ? Lavage actif à l'hexafluorine. Quelle est la concentration en acide chlorhydrique dans les deux fioles inconnues ? Volume initial d'acide chlorhydrique : 5 m L à 12 N Tracer la courbe d'étalonnage donnant la concentration en fonction de l'intensité lumineuse. En déduire C1 et C2. 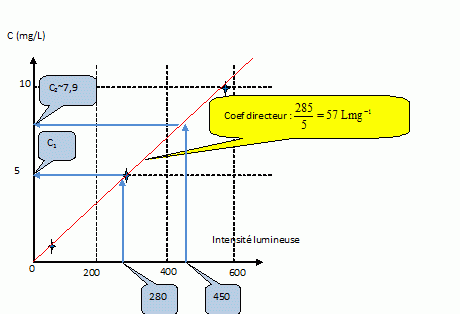 Calculer la teneur en cuivre dans la poudre de déprt. Echantillon n°1 : 5 mg / L soit dans 50 ml : 5*50 / 1000 = 0,25 mg ou 0,25 / 3,5 = 0,0714 ( 7,1 %) Echantillon n°2 : 7,9 mg / L soit dans 50 ml : 7,9*50 / 1000 = 0,395 mg ou 0,395 / 5,6 = 0,0705 ( 7,1 %) La poudre subit une perte au feu. Pour se faire, 130 mg sont chauffés en creuset de platine à 1000 °C pendant une heure, puis sont refroidis dans un dessicateur. La pesée indique une masse de 78 mg.Quelle est la perte de solide en % ? 130-78 = 52 mg puis 52/130 =0,40 ( 40 %). Quelle est la teneur en cuivre sur produit calciné ? Les produits volatils sont éliminés : dans 130 mg, la masse de cuivre est de : 130*0,071 =9,23 mg 9,23 mg de cuivre dans 78 mg de produit calciné : 9,23/78 = 0,118 ( 11,8 %)
Que signifie ppm ? partie par million Définissez la limite inférieure d'un vide primaire et citez un type de pompe appropriée. Le vide prrimaire ( 1000 à 1 hPa) est obtenu à l'aide de pompe à
palettes. Définissez la limite inférieure d'un vide secondaire et citez un type de pompe appropriée. Citez trois détecteurs utilisés en chromatographie. Détecteurs utilisables en
chromatographie en phase gazeuse. - détecteur électrique, basé sur le principe du pont de Wheatstone ( catharomètre ) - détecteur à absorption électronique - spectromètre de masse et la spectroscopie infrarouge. Citez trois analyseurs utilisés en spectrométrie de masse. - l'ionisation se fait à pression atmosphérique et la détection à haute pression
|
||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||
|
|