|
Acide sulfurique et métaux, catalyseur en chimie organique concours Caplp maths sciences 2009. |
|||||||||||||||||||
|
|||||||||||||||||||
|
Dans un tube à essais on introduit quelques morceaux de métal puis on ajoute un volume de 2 mL d'acide sulfurique. Les conditions opératoires et les observations des expériences sont regroupées dans le tableau ci-dessous :
Dihydrogène. Zn(s) + 2H+(aq) = Zn2+(aq) + H2(g). Le gaz qui décolore le permanganate de potassium est le dioxyde de soufre SO2(g). On donne : E°( Zn2+(aq) / Zn(s) = -0,76 V ; E°( H+(aq) / H2(g) ) = 0 V ; E°( Cu2+(aq) / Cu(s) = 0,34 V ; E°( SO42-(aq) / SO2(g) = 0,17 V. Pourquoi n'obtient-on pas le même gaz que dans le tube A ? Justifier. Le zinc est un réducteur plus fort que H2(g) ; le zinc est oxydé par H+(aq). Le cuivre est un réducteur moins fort que H2(g) ; le cuivre n'est pas oxydé par H+(aq). Ecrire l'équation bilan expliquant la décoloration du permanganate de potassium. 2 fois { MnO4-+8H++5e- = Mn2+ + 4H2O }, réduction 5 fois { SO2(g) + 2H2O = SO42-(aq) +4H+ + 2e- }, oxydation 2MnO4- + 5 SO2(g) + 2H2O =2 Mn2+ + 5SO42- +4H+. Quelles peuvent être les réactifs responsables de la formation de SO2(g) ? ( aucune équation bilan demandée. H2SO4, HSO4-. Pourquoi ne peut-on pas prévoir la formation du gaz SO2(g) d'après les données disponibles ? Il manque le potentiel redox du couple H2SO4 / SO2(g). Zn2+ + 2HO- =
Zn(OH)2 (s) ; K1 = 1/
([Zn2+][HO-]2)
= 1/Ks = 1014,3. Zn(OH)2 (s) + 2HO- =
Zn(OH)42- ;
K2 =
[Zn(OH)42-]/
[HO-]2. pKs(Zn(OH)2) = 14,3 ; constante de formation globale de Zn(OH)42- : log ß4 = 14,6. Zn2+ + 4HO- =Zn(OH)42- ; ß4 =[Zn(OH)42-] / ([Zn2+][HO-]4) = K2 K1 ; K2 = ß4 /K1 = ß4 Ks= 1014,6 * 10-14,3= 100,3 =2. Calculer le pH de début de précipitation puis celui de fin de dissolution du précipité. Ks = [Zn2+][HO-]2 = 10-14,3 ; [Zn2+] = 0,1 mol/L ; [HO-] = (10-13,3 )½ =2,24 10-7 mol/L [H3O+] = 10-14 / 2,24 10-7 =4,5 10-8 mol/L ; pH =7,3. Le précipité d'hydroxyde de zinc disparaît dès que tous les ions Zn2+ sont engagés dans le complexe [Zn(OH)4] 2- c'est à dire [Zn(OH)4] 2- =0,1 mol L-1. Zn(OH)2 (s) + 2HO- = Zn(OH)42- ; K2 = [Zn(OH)42-]/ [HO-]2. [HO-]2 = [Zn(OH)42-]/K2 = 0,1/2 = 0,05 ; [HO-] =0,05½ =0,223 pH = 14 + log( 0,223) = 13,3. On filtre le tube à essais A et on ajoute goutte à goutte une solution de soude concentrée au filtrat. Décrire les phénomènes observés ? Si l'acide était en excès, on observe un dégagement de chaleur suite à la réaction acide base, puis l'apparition d'hydroxyde de zinc, solide blanc vers pH=7,3, enfin la redissolution du précipité ; celle-ci est complète à pH = 13,3.
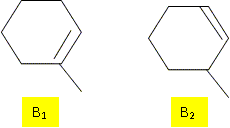
Le composé ci-dessous chauffé en présence d'acide sulfurique donne deux composés B1 (84%) et B2 ( 16 %).
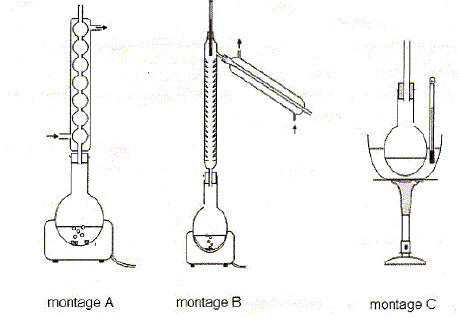
Le protocole opératoire est le suivant : dans un ballon, on introduit le composé A et l'acide sulfurique. On ajoute quelques gouttes de pierre ponce puis on adapte au ballon un montage de distillation fractionnée. On récupère le distillat puis on le lave avec une solution de soude à 10 % puis avec de l'eau distillée. On sèche finalement la phase organique qui contient B1 et B2. Citer la verrerie utilisée pour le lavage. Le lavage ( élimination des impuretées d'un solvant ) est une opération identique à l'extraction de deux liquides non miscibles : ampoule à décanter. Choisir le montage pour la distillation fractionnée parmi les propositions ci-dessous.
Montage B. Citer un désséchant utilisable. MgSO4 anhydre. Quel est le rôle de la pierre ponce ? Régulariser l'ébullition : le départ de l'ébullition est mieux contrôlé.
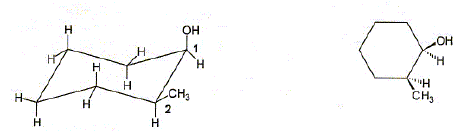
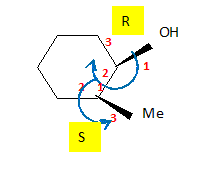
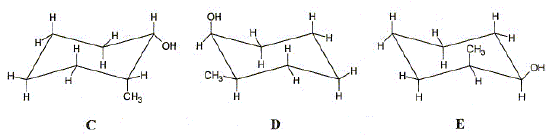
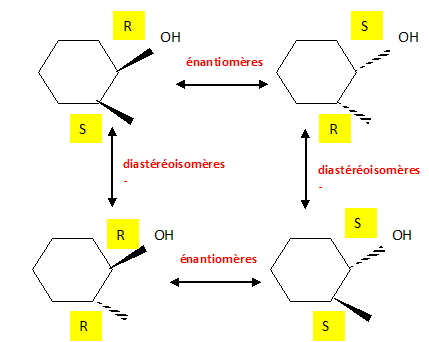
Nommer le composé A. 2 -méthylcyclohexan-1-ol Le composé A possède d'autres conformations chaise que celle représentée en perspective. Qu'est-ce qu'une conformation ? Différentes structures spatiales obtenues par rotation autour d'une ou plusieurs liaisons. Identifier une conformation chaise du composé A parmi les trois possibilités ci-dessous.
Dans la perspective initiale OH est en position axiale et CH3 en position équatoriale ( comme en D ), tous deux vers le haut. Par rotation OH passe en position équatoriale et CH3 en position axiale, en restant vers le haut : donc E.
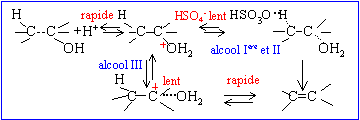
Quel est le rôle de l'acide sulfurique ? Catalyseur. En remplaçant l'acide sulfurique par l'acide chlorhydrique, on observe la formation d'autres produits. Expliquer pourquoi ? Formation de dérivés chlorés. Le nucléophile Cl- peut réagir avec le carbocation juste après sa formation. Citer une méthode physicochimique capable de séparer B1 et B2 ( ce sont deux liquides à température et pression ambiante de température d'ébullition très proche) Chromatographie.
|
|||||||||||||||||||
|
c |
|||||||||||||||||||
|
|