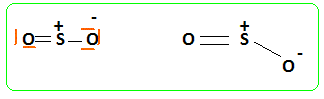|
L'acide sulfurique: préparation, propriétés acidobasiques concours Caplp maths sciences 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
L'acide sulfurique est fabriqué à partir du dioxyde de soufre SO2(g). L'exercice s'intéresse à ce gaz. Exercice 1. L'acide sulfurique concentré que l'on trouve chez les fournisseurs de laboratoires a été obtenu par solubilisation du trioxyde de soufre SO3 (g) dans l'acide sulfurique dilué. A partir de quelles matières premières est synthétisé industriellement le dioxyde de soufe ? Combustion du soufre ou de H2S dans le dioxygène, grillage des sulfures ( pyrite) L'élément soufre possède 4 isotopes naturels dont l'isotope 3316S. Quels noms et symboles donne t-on aux nombres 33 et 16 ? A = 33 : nombre de nucléons ; Z= 16 : nombre de charge, numéro atomique. Déterminer le nombre de protons et de neutrons dans un noyau de l'isotope 3316S. 16 protons et 33-16 = 17 neutrons. Qu'appelle t-on isotope ? Deux isotopes ont le même numéro atomique : ils ne diffèrent que par leur nombre de neutrons. Les atomes de soufre possèdent 16 électrons. En déduire la configuration électronique fondamentale d'un atome de soufre. 1s2 2s2 2p6 3s2 3p4.
Décrire la
géométrie de cette
molécule. Type AX2E,
forme coudée en V. 2SO2(g) + O2(g) = 2SO3(g). C'est une réaction exothermique et équilibrée, catalysée par l'oxyde de vanadium V2O5 (s). On introduit à 500 °C et sous 1 bar, une mole de O2(g) et une mole de SO2(g). L'avancement x de la réaction est x =0,48 mol. Les gaz sont supposés parfaits. Exprimer puis calculer la constante K de cet équilibre.
Fraction molaire x(SO2(g)) =(1-2xéq) /( 2-xéq) ; x(O2(g)) =(1-xéq) /( 2-xéq ) ; x(SO3(g)) =2xéq /( 2-xéq) Pressions partielles : PSO2(g) =P (1-2xéq) /( 2-xéq) ; PO2(g) =P (1-xéq) /( 2-xéq) ; PSO3(g) =P 2xéq /( 2-xéq) avec P= 1 bar. K = P2SO3(g) / (PO2(g P2SO2(g))) = 4x2éq( 2-xéq) /[(1-xéq)(1-2xéq)2 ] K = 4*0,482( 2-0,48) /[(1-0,48)(1-2*0,48)2 ] = 1,68 103. Comment peut-on déplacer l'équilibre vers la formation de SO3(g) ? Citez trois méthodes différentes. - Une réaction exothermique est favorisée par une diminution de la température. - Travailler avec un excès de l'un des réactifs. - Travailler à pression plus élevée ( le nombre final de moles est inférieur au nombre initial de moles). Qu'est-ce qu'un catalyseur ? Un catalyseur est une espèce qui augmente la vitesse d'une réaction chimique ; il participe à la réaction mais il est régénéré à la fin et n'apparaît pas dans le bilan.
Une solution d'acide sulfurique est dosée par pHmétrie. Dans un bécher on introduit Va=10 mL de la solution d'acide sulfurique à doser puis un volume de 90 mL d'eau distillée. Des électrodes reliées à un pHmètre sont ajoutées. On dose par une solution de soude de concentration molaire cb= 0,209 mol/L et on trace la courbe montrant l'évolution du pH suivant le volume de soude Vb ajouté. On observe un unique saut de pH pour Vb=9,8 mL. Citer la verrerie utilisée pour introduire la solution d'acide sulfurique dans le becher. Volume très précis, donc pipette jaugée + pipeteur. Citer la verrerie utilisée pour introduire l'eau distillée dans le becher. Volume peu précis, donc éprouvette graduée. Donner le nom des électrodes nécessaires pour un dosage pH-métrique. On utilise une électrode au calomel saturée ( référence) et une électrode de verre( mesure) ou encore une électrode combinée. Comment a t-on déterminé le volume Vb=9,8 mL ? Méthode des tangentes ou bien la courbe dérivée ( si elle est tracée ) présente un pic au voisinage de l'équivalence. L'acide sulfurique est undiacide. Sa première acidité est forte et sa deuxième est faible ( pKa = 2,0). Qu'appelle t-on acide fort ? La réaction d'un acide fort avec l'eau est totale. A quel couple acide / base fait référence le pKa ? HSO4- / SO42-. Ecrire les équations des réactions susceptibles d'avoir lieu lors du dosage. H2SO4 + HO- = HSO4- + H2O (1) HSO4- + HO- = SO42- +H2O (2) Bilan : H2SO4 + 2HO- =SO42- +2H2O. Calculer les constantes d'équilibre de ces réactions puis en déduire pourquoi on observe un seul saut de pH. K1 = [HSO4-] /([H2SO4][ HO-]) = [HSO4-][H3O+] /([H2SO4][ HO-][H3O+]) = 100 / 10-14 = 1014. K2 = [ SO42-] /([HSO4-][ HO-]) = [ SO42-][H3O+] /([HSO4-][ HO-][H3O+]) = 10-2 / 10-14 = 1012. Ces deux constantes sont du même ordre de grandeur : les réactions ont lieu simultanément.
A l'quivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques. n(HO-) = cbVb ; n(acide) = caVa et H2SO4 + 2HO- =SO42- +2H2O. Par suite : n(HO-) = 2 caVa ; cbVb = 2caVa ; ca =cbVb /(2Va) = 0,209*9,8 / 20 =0,10 mol/L. Calculer le pH de 100 mL d'une solution d'acide sulfurique de concentration molaire ca. La première acidité est forte d'où n(HSO4-) = 0,1 ca = 0,010 mol. Le couple acide base HSO4- / SO42- fixe le pH :
Port de blouse, gants et lunnettes. Prélever 5,4 mL de solution mère à la pipette jaugée + pipeteur. Placer dans la fiole jaugée de 1 L contenant 1/3 d'eau distillée puis compléter jusqu'au trait de jauge avec de l'eau distillée. Bouger, agiter pour rendre homogène.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|