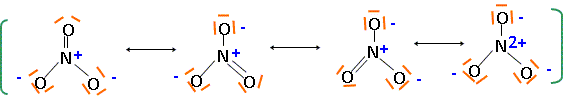|
Oxydoréduction avec le zinc : spectrophotométrie, pile concours caplp interne 2009. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le laiton 36/64 est composé de 36% de zinc et de 64 % de cuivre en masse. A l'état naturel le zinc possède 5 isotopes : 64Zn, 66Zn, 67Zn, 68Zn, 70Zn et le cuivre 2 isotopes 63Cu, 65Cu. Définir " isotope", donner la composition du noyau pour 6630Zn et 6529Cu. Des isotopes ne différent que par leur nombre de neutrons : ils ont le même numéro atomique. 6630Zn : 30 protons et 66-30 = 36 neutrons ; 6529Cu : 29 protons et 65-29 = 36 neutrons. Donner la structure électronique du zinc et du cuivre dans leur état fondamental, ainsi que celle des ions Zn2+ et Cu2+. Cu : 1s2 2s2 2p6 3s2 3p6 4s1 3d10 ; Cu2+ : 1s2 2s2 2p6 3s2 3p6 3d9 ; Zn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 ; Zn2+ : 1s2 2s2 2p6 3s2 3p6 3d10. Préciser quelles sont les espèces chimiques susceptibles d'être oxydées au cours de la réaction. Pouquoi ? E°(NO3-/NO) = 0,957 V; E°(Cu2+/Cu) = 0,342 V ; E°(Zn2+/Zn) = -0,762 V L'ion nitrate est l'oxydant le plus fort ; les métaux cuivre et zinc peuvent être oxydés. Ecrire les formes limites des formules de Lewis de l'ion nitrate qui traduisent l'équivalence des atomes d'hydrogène. Comment appelle t-on ces formes ?
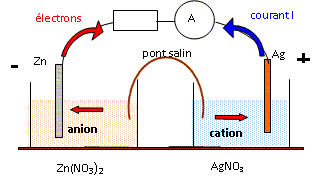
NO3- + 4 H+ +3 e- =NO + 2H2O ; Zn = Zn2+ + 2 e- ; Cu = Cu2+ + 2 e- ; 2NO3- + 8 H+ +3Zn =2NO + 4H2O + 3Zn2+. 8NO3- + 8 H+ +3Zn =2NO + 4H2O + 3Zn(NO3)2. 2NO3- + 8 H+ +3Cu =2NO + 4H2O + 3Cu2+. 8NO3- + 8 H+ +3Cu =2NO + 4H2O + 3Cu(NO3)2. Qu'observe t-on au cours de la réaction ? Pourquoi ? Quelles précautions faut-il prendre ? Oxydation de NO à l'air : NO + ½O2 = NO2, gaz de couleur brune, gaz toxique. ( travail sous hotte aspirante). L'acide nitrique est corrosif : port de blouse, gants et lunettes. La détermination de la masse de l'échanillon donne m = 2,73 g. Calculer la masse minimal d'acide nitrique du commerce pour que tout l'échantillon réagisse. masse de zinc : 2,73*0,36 = 0,9828 g ; quantité de matière de zinc : n = 0,9828/65,4 =1,50 10-2 mol. masse de cuivre : 2,73*0,64 = 1,747 g ; quantité de matière de zinc : n1 = 1,747 / 63,5 =2,75 10-2 mol. Quantité de matière d'ion oxonium apporté par l'acide nitrique : 8/3 (n+n1) =8/3 (1,50+2,75) 10-2 = 0,1134 mol. Masse molaire HNO3 : M = 63 g/mol ; masse d'acide nitrique : 63*0,1134 = 7,14 g. La solution commerciale contient en masse 62% d'acide nitrique ; masse de solution commerciale à utiliser : 7,14/0,62 = 11,5 g. Déterminer la concentration en ions zinc(II) et cuivre (II) de la solution dans la fiole jaugée. [Zn2+] =n /V = 0,015 / 0,25 = 0,06 mol/L ; [Cu2+] =n /V = 0,0275 / 0,25 = 0,11 mol/L.
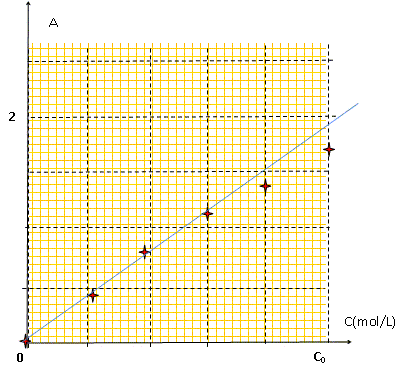
Donner le principe des dosages spectrophotométriques. Travailler à une longueur d'onde pour laquelle la solution absorbe au maximum Réaliser une échelle de teinte et pour chaque solution mesurer l'absorbance ; construire le graphe A = f(C), il s'agit d'une droite. Mesurer l'absorbance de la solution de concentration inconnue et utiliser le graphe pour trouver la concentration.
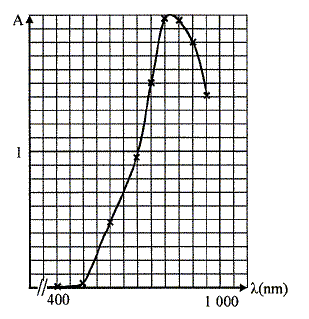
Pour préparer la solution mère M0, on prépare une solution aqueuse de sulfate de cuivre II en dissolvant 18,71 g de sulfate de cuivre pentahydraté CuSO4, 5H2O dans un becher avec de l'eau distillée puis on introduit cette solution dans une fiole de 500 mL, on ajuste au trait de jauge et on agite. Les mesures d'absorbance réalisées à partir de la solution mère à différentes longueur d'onde ont permis de tracer la courbe ci-dessous. La longueur d'onde pour l'absorbance maximale est -elle celle attendue ? Pourquoi ?
L'absorbtion est maximale vers 800 nm, limite du rouge et de l'infra-rouge. La solution de sulfate de cuivre est de couleur "cyan" : elle absorbe le rouge, couleur complémentaire du "cyan". Préparation des solutions filles Si : dans une fiole jaugée de 25 mL on introduit Vi mL de la solution M0, on ajuste au trait de jauge, on bouche et on agite. Les mesures d'absorbance A ( à 810 nm) effectuées avec les solutions Si ont donné les résultats suivants :
La mesure d'absorbance de la solution S donne 1,33, ce résultat est-il en accord avec la valeur attendue ? C ~C0/1,3, d'après le tableau. On dissout 18,71 g de sulfate de cuivre pentahydraté CuSO4, 5H2O dans une fiole de 500 mL . Masse molaire sulfate de cuivre pentahydraté : M= 63,5+32+64+90 =249,5 g/mol n = m/M = 18,71 / 249,5 =7,10 10-2 mol ; C0 = n/V =7,10 10-2 m /0,5 =0,142 mol/L d'où C =[Cu2+] = C0 /1,3 = 0,11 mol/L. ( accord avec la valeur trouvée précédemment).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|