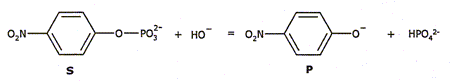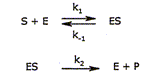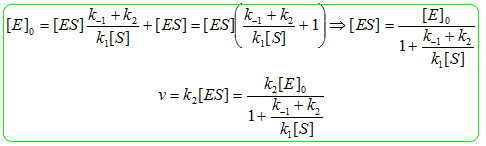|
Solution tampon, catalyse enzymatique concours Capes interne 2009 |
|||||||
|
|||||||
|
Le bilan de la réaction est le suivant :
La réaction a lieu dans un milieu tamponné, à pH=9,8. Préparation de la solution tampon. Quelles sont les propriétés d'une solution tampon. Une solution tampon modère les variations de pH suite à l'ajout modéré d'un acide fort ou d'une base forte . Lors d'une dilution modérée, le pH d'une solution tampon ne varie pas. La solution tampon utilisée est un mélange d'un acide noté RNH3+ et de sa base conjuguée notée RNH2. Le pKa du couple est de 8,2 à 25°C. En notant c0 la concentration molaire totale du tampon, déterminer, en fonction de c0, les concentrations en RNH3+ et RNH2 notées respectivement ca et cb dans la solution tampon à pH=9,8. c0 = ca + cb et pH = pKa + log (cb /ca ) ; log (cb /ca )= pH-pKa =9,8-8,2 = 1,6 cb /ca = 101,6 =39,8 ; c0 = ca +39,8ca ; ca = 2,45 10-2 c0 ; cb=0,975 c0 ; Que peut-on penser des qualités d'une solution de pH=9,8 préparée à l'aide d'un couple acide /base de pKa = 8,2 ? Le pouvoir tampon est maximum lorsque pH = pKa. Ce nest pas le cas ici. Calculer les masses
ma
et
mb
si c0 = 5,0 10-2
mol/L. M(RNH3Cl)=Ma =157,6 g/mol
; M(RNH2)=Mb =121,1
g/mol. ma
=
caMa =2,45
10-2* 5,0 10-2 *157,6
=0,193 g. mb
=
cbMb =0,975*
5,0 10-2 *121,1
=5,90
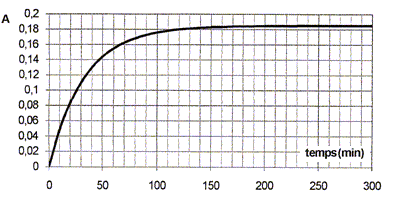
g. La réaction S + HO- = P + HPO42- est suivie en mesurant l'absorbance du milieu réactionnel au cours du temps à la longueur d'onde l= 400 nm. A cette longueur d'onde seul P absorbe le rayonnement et l'absorbance suit la loi de Beer lambert. On réalise l'expérience avec une concentration initiale en substrat [S]0 = 10-5 mol/L. On enregistre l'évolution de l'absorbance au cours du temps. La courbe obtenue est donnée ci-dessous :
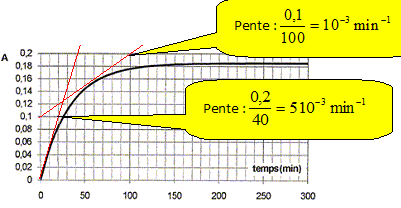
On donne : coefficient d'absorption de P à 400 nm eP= 1,85 104 mol-1 L cm-1 ; longueur de la cuve : l=1,00 cm. Donner la définition de la vitesse volumique de la réaction. v = 1/V dx/dt= d[P]/dt avec V : volume (L) de la solution et x : avancement (mol) Exploiter la courbe pour en déduire la vitesse à t=0 et à t = 50 min.
A = eP l [P] ; dA/dt = eP l d[P]/dt ; v = 1/(eP l)dA/dt v(t=0) = 1/(1,85 104)*5 10-3 =2,7 10-7 mol L-1 min-1 ; v(t=50) = 1/(1,85 104)* 10-3 =5,4 10-8 mol L-1 min-1. Comment la vitesse évolue t-elle au cours du temps ? Pour quelle raison ? La concentration des réactifs est un facteur cinétique : elle diminue au cours du temps ; la vitesse diminue donc au cours du temps.
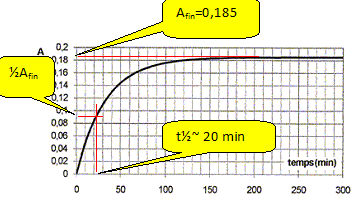
Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Dans les conditions de l'expérience, la vitesse de la réaction suit la loi de vitesse : v = k[S]1. Quel est l'ordre de la réaction ? Quelle est la dimension de k ? La réaction est d'ordre 1 ; [k] =T-1. Montrer que [S(t)] est solution d'une équation différentielle du premier ordre. La résoudre pour exprimer [S] en fonction du temps, de [S]0 et de k. v = -d[S] /dt = k[S] ; d[S] /[S] = -kdt ; dln[S] = -kdt ln[S] -ln[S]0 = -kt ; [S] = [S]0 exp(-kt). En déduire l'expression du temps de demi-réaction en fonction de k. Evaluer k . ln(0,5[S]0 ) -ln[S]0 = -kt½ ; ln2 = kt½ ; t½ = ln2 / k ; k = ln2 / t½ =ln2 / 20 ; k ~ 3 10-2 min-1. Etude du modèle de Michaelis et Menten de la catalyse enzymatique. La réaction étudiée est catalysée par une enzyme, la phosphatase alcaline, que l'on notera E. Le mécanisme simplifié de la réaction catalysée est le suivant. Il est valable au début de la réaction. Chacune des étapes est élémentaire, les constantes k1, k-1 et k2 en sont les constantes de vitesse.
Qu'est ce qu'un catalyseur ? Un catalyseur accélère une réaction thermodynamiquement possible ; il n'apparaît pas dans le bilan, étant régénéré en fin de réaction.
|
|||||||
|
0,128 |
|||||||
|
|