|
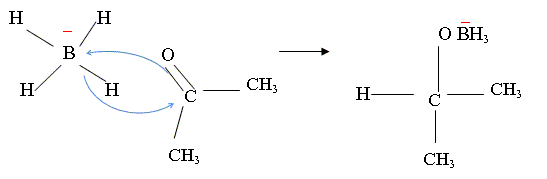
Réduction des carbonyles par NaBH4 concours chimie Capes 2009. |
|||||||
|
|||||||
|
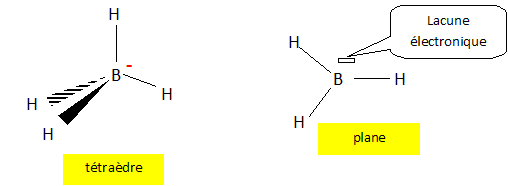
Donner la configuration électronique de l'état fondamental de l'atome de bore ( Z=5). Sur cet exemple, définir les électrons de coeur et les électrons de valence. 1s2 2s2 2p1. La couche de valence (ou couche périphérique) d'un atome est sa dernière couche électronique occupée ( 2s2 2p1). Les électrons de cœur appartiennent aux couches pleines de nombre quantique principal inférieur (1s2). Préciser la position de l'atome de bore dans la classification périodique des éléments. De quand date approximativement la classification de Mendeleiev ? Seconde période, colonne numéro 13 ( III A). 1869. On considère les espèces BH3 et BH4-. Préciser les formules de Lewis et leur géométrie d'après la méthode VSEPR.
Dosage NaBH4 par oxydo-réduction. KIO3 : 214,0 ; NaBH4 :
37,82 ; KI : 166,01. Potentiel standard ( V) : E°(IO3-/I2)
=1,19 ; E°(I2 / I-)
=0,62 ;
E°(S4O62-
/S2O32-
) =0,09. On souhaite déterminer le degré de
pureté du borohydrure de sodium commercial
avant de l'utiliser comme agent réducteur.
On se propose de'effectuer ce contrôle par
dosage volumétrique. Dans un premier temps les ions borohydrure
réagissent quantivement en milieu basique
avec un excès d'ion iodate
IO3- suivant la
réaction : 4IO3- +
3BH4- = 4 I- +
3H2BO3- + 3
H2O
(1) Pour doser les ions iodate en excès, on
les fait réagir en milieu acide avec un
excès d'ion iodure ( réaction 2) ; le
diiode formé est dosé par les ions
thiosulfate
S2O32-. (
réaction 3) Dosage en retour, dosage indirect. Mode opératoire : - Dans un becher, verser une masse m1 d'iodate de potassium de 2,14 g. Ajouter environ 60 mL de soude à 0,2 mol/L et mettre la solution sous agitation. - Peser une masse m2 de borohydrure de sodium de 0,200 g et l'ajouter par petites portions à la solution précédente. - Transvaser la solution obtenue dans une fiole jaugée de 100 mL, puis compléter jusqu'au trait de jauge avec la solution de soude. Soit S cette solution. - Homogénéiser la solution S obtenue, puis prélever un volume VS = 10,0 mL. - Ajouter 1,0 g d'iodure de potassium solide et acidifier lentement avec de l'acide chlorhydrique à 2 mol/L jusqu'à obtenir un pH voisin de 1. La couleur brune du diiode doit apparaître. Doser la solution obtenue avec une solution de thiosulfate de sodium à Cthio = 0,100 mol/L. ( VE = 17,9 mL) Quel indicateur de fin de réaction peut-on utiliser pour repérer l'équivalence de manière plus précise ? Préciser les changements de couleur? L'empois d'amidon ou le thiodène donne en présence de diiode une teinte violette noire. On en ajoute une pointe de spatule à la fin d'un titrage pour mettre en évidence la disparition totale du diiode. Ecrire les équations des réactions d'oxydoréduction 2 et 3 et montrer qu'elles sont totales en calculant la valeur de leur constante d'équilibre. 2S2O32- = S4O62- + 2e- ; E1 = E°(S4O62- /S2O32- ) + 0,03 log ([S4O62-] /[S2O32- ]2) I2 +2e- = 2 I- ; E2 =E°(I2 / I-) =0,62 + 0,03 log ([I2]/[I-]2) 2S2O32- + I2 = S4O62- +2 I- (3) ; K3 = [S4O62-] [I-]2 / ([S2O32- ]2[I2]) A l'équilibre E1 = E2 =0,09 +0,03 log ([S4O62-] /[S2O32- ]2) = 0,62 + 0,03 log ([I2]/[I-]2) 0,62-0,09 = 0,03 log K3 ; K3 = 4,6 1017, valeur grande, réaction totale. IO3- +6H+ + 5e- = ½I2 + 3H2O ; E3 =E°(IO3-/I2) =1,19 + 0,012 log ( [IO3-] [H+]6/[I2]½) IO3- +6H+ + 5 I- = 3 I2 + 3H2O (2) ; K2 = [ I2]3 / ([IO3- ][H+]6[I-]5) A l'équilibre E3 = E2 =1,19 + 0,012 log ( [IO3-] [H+]6/[I2]½) = 0,62 + 0,03 log ([I2]/[I-]2) 1,19 + 0,012 log ( [IO3-] [H+]6/[I2]½) = 0,62 + 0,012 log ([I2]2,5/[I-]5) 1,19 -0,62 = 0,012 log K2 ; K2 =3,1 1047, valeur grande, réaction totale.
Réaction (3) : n(I2) = 0,5 n(S2O32-) = 0,5 Cthio VE = 0,5*0,100*17,9 10-3 =8,95 10-4 mol. Réaction (2) : n(iodate) = n(I2)/3 =8,95 10-4 / 3=2,983 10-4 mol ( dans 10 mL de la solution S) soit dans 100 mL de la solution S : 2,983 10-3 mol. En déduire la quantité de matière d'ions borohydrure présents initialement dans la solution S. Quel est le degré de pureté, exprimé en pourcentage, du borohydrure de sodium commercial ? Quantité de matière initiale d'iodate de potassium m / M = 2,14 / 214 = 0,0100 mol Quantité de matière d'ions iodate ayant réagit avec BH4- : 0,0100 - 2,983 10-3 = 7,02 10-3 mol. Réaction (1) : n(BH4-) = 0,75 n(iodate) = 0,75*7,02 10-3 =5,265 10-3 mol. soit une masse de NaBH4 : 37,82*5,265 10-3 =0,199 g. 0,199 / 0,2 *100 =99,5 %.
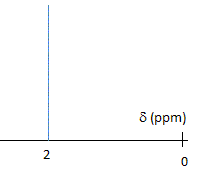
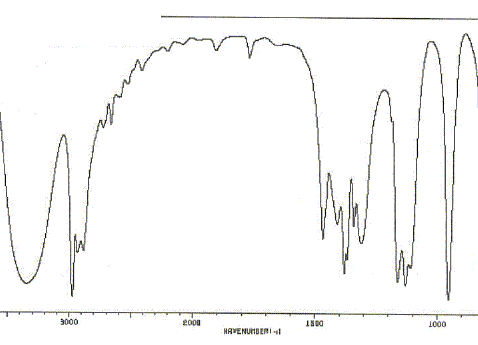
Schématiser le spectre RMN 1H de l'acétone. Justifier la multiplicité du ( des) signal (aux). Comparer la valeur du déplacement chimique à celle des atomes d'hydrogène d'un alcane. Justifier. Les six atomes d'hydrogène des deux groupes "méthyle" ont le même environnement : ils sont équivalents. N'ayant aucun proche voisin sur le carbone en alpha, on observe un singulet. L'effet inducteur attractif du carbonyle diminue la densité électronique autour de l'hydrogène : on observe un déplacement chimique vers 2 ppm, alors que dans les alcanes on observe des multiplets entre 0,9 et 1,5 ppm. Sur le spectre IR de l'acétone, on observe une bande d'absorption à 1700 cm-1. A quelle liaison est-elle due ? De quel type de vibration s'agit-il ? Vibration de valence ( élongation) de la liaison C=O, carbonyle.
|
|||||||
|
|