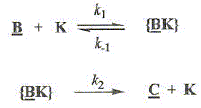|
Le menthol : stéréoisomères, cinétique concours chimie Capes 2009. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
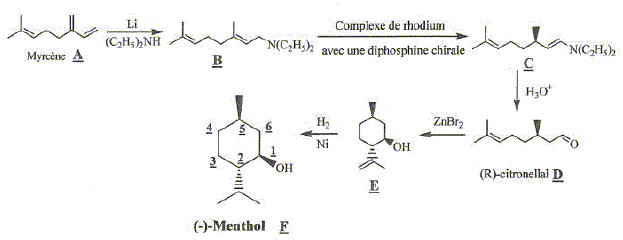
Le(-)-menthol ( noté F) est le seul des stéréoisomères du menthol à posséder des propriétés olfactives et gustatives apprèciées, il est ajouté aux chewing-gums, friandises, dentifrices.... Sa production industrielle mondiale, de l'ordre de 5 000 t/an, est principalement d'origine naturelle par extraction de Mentha arvensis. Cepandant depuis 1983, une firme japonaise le produit de manière stéréosélective à partir du myrcène A, composé peu couteux. Ce procédé fournit actuellement environ 30 % du marché mondial du (-)-menthol. La chiralité est introduite dans la seconde étape B--> C qui est l'étape clé de cette synthèse. Cette étape utilise comme catalyseur, un complexe de rhodium possédant un ligand diphosphine chiral.
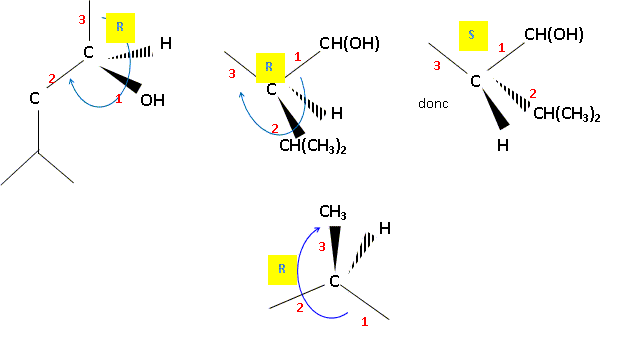
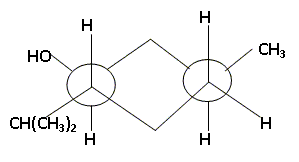
Donner le nom du menthol en nomenclature officielle. 5-Méthyl-2-(1-méthyléthyl)-cyclohexan-1-ol . Combien de stéréoisomères de configuration le menthol compte t-il ? Justifier. Trois atomes de carbone asymétriques donc 23 = 8 stéréoisomères de configuration. Préciser le descripteur
stéréochimique ( configuration absolue) de
chaque atome de carbone asymétrique du (-)-menthol ?
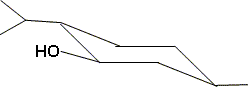
Justifier. Les trois substituants sont en position
équatoriale ; la position équatoriale
minimise les interactions avec les atomes
d'hydrogènes voisins. ( l'énergie
potentielle est la plus basse ) Représenter ce
conformère en projection de Newman de
façon que l'axe joignant les carbone 1 et 2
soit perpendiculaire à la feuille, l'atome
de carbone 2 étant à l'avant de la
feuille. L'étape -clé est schématisée ci-dessous : B ---> C en présence d'un catalyseur noté K. On suppose que la cinétique de cette réaction est analogue à celle d'une catalyse enzymatique dans le modèle de Michaelis et Menten. On peut ainsi expliquer cette cinétique par le schéma suivant dans lequel {BK} représente le complexe formé entre le catalyseur K et le substrat B :
Expliquer pourquoi on peut appliquer l'approximation de l'état quasi-stationnaire au complexe {BK}. Lorsque certains intermédiaires réactionnels, très réactifs, interviennent en quantité très restreinte (consommés dès qu’il se forment), on peut supposer que leur concentration varie de façon négligeable (quasi-stationnaire). Ecrire l'équation de conservation de la matière pour le catalyseur K. On note [K]0 la concentration initiale en catalyseur. [K]0 =[K]+[BK] Donner l'expression de [BK] en fonction de k1, k-1, k2, [B] et [K]0. d[BK]/dt = 0 =k1[B] [K] - k-1[BK]-k2[BK] ; [K] = ( k-1+k2 )[BK] / (k1[B]) [K]0 =( k-1+k2 )[BK] / (k1[B])+[BK] = [BK] ( 1+( k-1+k2 )/ (k1[B]) ). [BK] =[K]0 / ( 1+( k-1+k2 )/ (k1[B]) ). Montrer que la vitesse v de formation du produit C peut se mettre sous la forme v = Vm[B] / (Km+[B] ). v = k2[BK] = [K]0k2 / ( 1+( k-1+k2 )/ (k1[B]) ). v = [K]0k2 k1[B] / ( (k1[B] +( k-1+k2 ) ). On pose Vm = [K]0k2 k1 et Km = ( k-1+k2 )
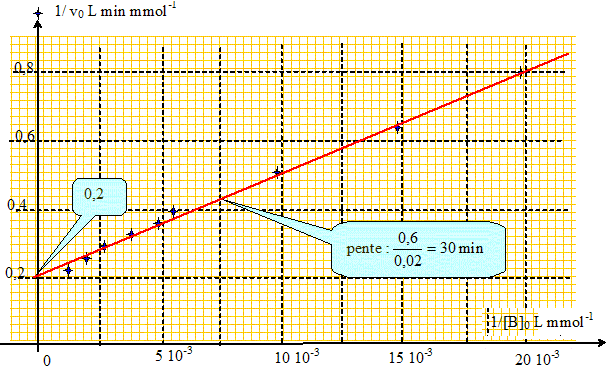
v0 = Vm[B]0 / (Km+[B]0 ) ; 1/v0 = Km/(Vm[B]0 ) + 1/Vm. On va représenter la droite d'équation 1//v0 = f(1/[B]0 ) : coefficient directeur : Km/Vm ; ordonnée à l'origine : 1/Vm.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|