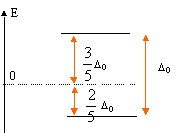|
Champ cristallin, autour du rhodium concours chimie Capes 2009. |
|||||||
|
|||||||
|
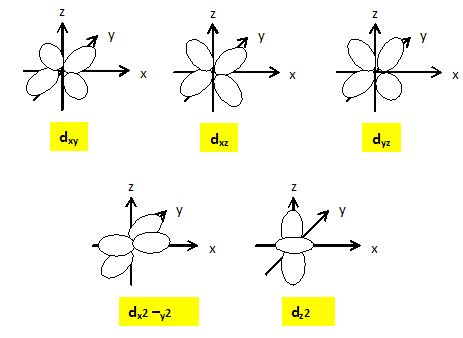
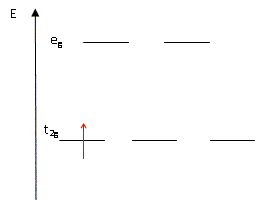
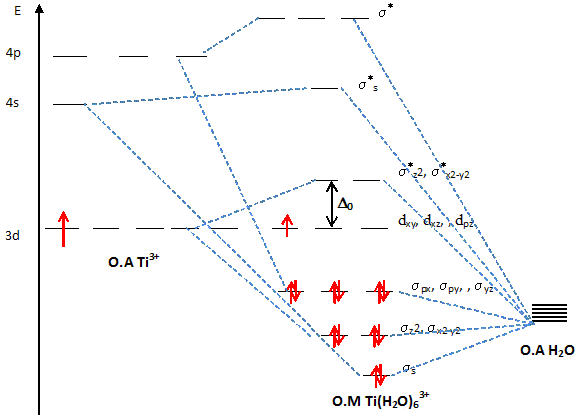
Expliquer pourquoi pour un complexe octaèdrique, dans la théorie du champ cristallin, les orbitales d sont séparées en deux groupes d'énergie différentes. Les 5 O.A nd d'un élément chimique ont la même énergie : elles sont dégénérées. Lorsqu'un élément de transition subit l'influence du champ électrostatique de ligands il y a levée partielle de dégénérescence. Dans le cas du champ octaèdrique les O.A se séparent en deux niveaux : niveau t2g : les orbitales dxy, dyz et dxz qui ne pointent pas en direction des ligands sont stabilisées. niveau eg : les orbitales dx²-y² et dz² pointent en direction des ligands et sont déstabilisées. il y a éclatement des niveaux énergétiques en deux sous niveaux : D0 énergie d'éclatement du champ cristallin.
Un ligand à champ fort est un ligand pour lequel l'éclatement D0 du champ cristallin est supérieur à l'énergie d'appariement P: le maximum d'électrons sont appariés et le spin est faible. Un ligand à champ faible est un ligand pour lequel l'éclatement D0 du champ cristallin est inférieur à l'énergie d'appariement P: le maximum d'électrons sont célibataires et le spin est fort. Quelles sont les
configurations électroniques de l'atome de
titane et de l'ion Ti3+ dans
l'état fondamental ? Ti : 1s2 2s2
2p6 3s2 3p6
4s2 3d2 ; Ti3+ :
1s2 2s2 2p6
3s2 3p6 3d1. Préciser
l'occupation des orbitales eg et
t2g de l'ion métallique
Ti3+ dans le complexe octaèdrique
hexaaquatitane (III) dans l'état
fondamental.
Le spectre d'absorption de ce complexe présente une bande avec un maximum vers 493 nm. Expliquer pourquoi l'ion Ti3+ est pourpre en solution aqueuse. La solution absorbe le bleu vert ( l= 493 nm) ; l'oeil perçoit la couleur complémentaire du bleu vert, c'est à dire le "pourpre". Quel est le phénomène responsable de l'absorption de la radiation ? Transition électronique eg--> t2g. En déduire l'écart énergétique ( en eV) entre les orbitales eg et t2g. E = h c / l = 6,63 10-34 * 3 108 / 493 10-9 = 4,03 10-19 J 4,03 10-19 /1,6 10-19 = 2,52 eV.
Le rhodium appartient à la famille des platinoïdes ( métaux du groupe platine MGP). Elle comprend six métaux étroitement apparentés qui se trouvent généralement ensemble : le platine, le palladium, le rhodium, le ruthénium, l'irridium et l'osmium. Au début du XIXe siècle, le platine, et plus tard, le palladium et le rhodium ont pu être séparés de leurs minerais respectifs dans lesquels ils se trouvent à l'état natif. Citer un métal n'appartenant pas à la famille des platinoïdes se trouvant lui aussi à l'état natif dans le minerai. Le cuivre. Citer deux types de minerai dans lesquels se trouvent les éléments métalliques ainsi qu'un exemple de minerai pour chacun de ces types. Oxydes ( bauxite riche en Al2O3) ; sulfures ( galène PbS) ; carbonates ( malachite Cu2 CO3 (OH)2 ) Citer une application industrielle du rhodium. - catalyseur en chimie ( voiture à essense ) et élément chauffant pour les hautes températures - anticathode de tube à RX, - application sur des miroirs.
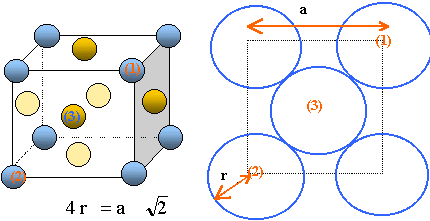
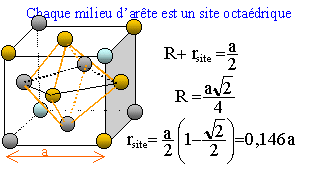
Dessiner la maille et indiquer la coordinence du rhodium.
il y a contact des sphères suivant la diagonale d'une face du cube. Coordinence ou nombre de plus proche voisins : 12.
|
|||||||
|
|