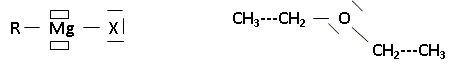|
Le catalyseur de Wilkinson : réaction d'échange de ligands concours chimie Capes 2009. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
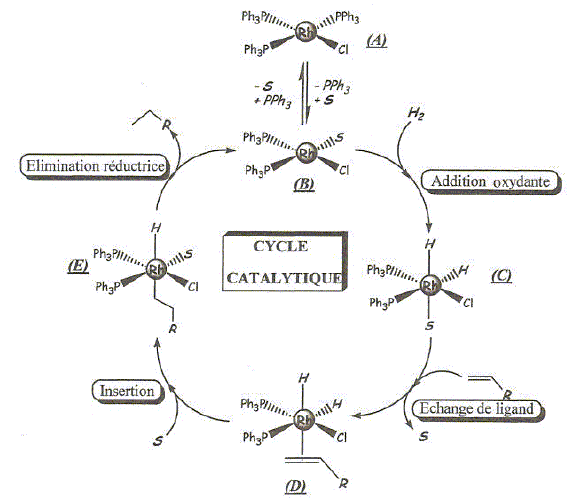
Ce complexe noté A est stable à l'état solide, mais en solution dans l'éthanol, il perd un ligand triphénylphpshine qui 'est remplacé par une molécule de solvant pour donner B. C'est le complexe B qui est ensuite engagé dans le cycle catalytique dont le mécanisme est donné ci-dessous. On se propose d'étudier deux étapes, ainsi que les propriétés des complexes des métaux de transition et du rhodium.
La synthèse d'un organomagnésien
est aussi une réaction oxydante : d'un
dérivé halogéné sur le
métal magnésium ( Z=12). Quel scientifique a
obtenu le prix Nobel pour la découverte des
organomagnésien ?
En quelle
année ? V. Grignard, Nobel 1912. Ecrire
l'équation-bilan de la synthèse du
bromure
d'éthylmagnésium. Dans l'éther anhydre : Mg +
CH3-CH2-Br --->
CH3-CH2-Mg-Br RCl < RBr < RI. Force de la liaison C-X : C-Cl ( 328 kJ/mol) ; R-Br ( 276 kJ/mol) ; R-I ( 240 kJ/mol) ; Un anion gros et polarisable est un meilleur groupe partant ( I- est meilleur que Cl-). Proposer une justification de ce terme addition oxydante. Nombre d'oxydation du magnésium : n.o(Mg) = 0 ; n.o(RMgX) = +II : le n.o du magnésium croît, donc oxydation. Le métal magnésium met en oeuvre deux liaisons dans RMgX, aucune dans Mg(s). On peut utiliser un étheroxyde comme solvant lors des synthèses d'un organomagnésien du type R-Mg-Br. Donner la représentation de Lewis d'un organomagnésien RMgX, ainsi que celle de l'éthoxyéthane.
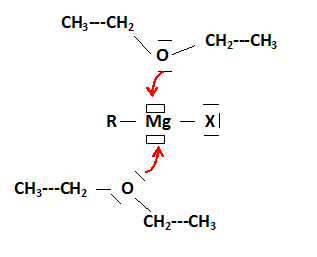
Les petits rectangles correspondent à des lacunes électroniques. Représenter l'interaction possible entre l'organomagnésien et les molécules d'éthoxyéthane et justifier le choix de cet étheroxyde comme solvant. RMgX est un acide de Lewis ; un solvant, base de Lewis stabilise l'organomagnésien. Si le solvant est trop basique, la réactivité du magnésien diminue. L'éther éthylique est un solvant volatil, assez facile à éliminer. Pourquoi lors de la mise en oeuvre expérimentale, dispose t-on de bains d'eau froide et tiède ainsi que de diiode ? Eau tiède : la température est un facteur cinétique : augnemtation de la vitesse initiale. Eau froide : la réaction est exothermique: après le démarrage de celle-ci il faut pouvoir la ralentir. Diiode : casser la couche de MgO recouvrant le magnésium, décapage du magnésium, accélèrer le démarrage de la réaction. Sur quel faits expérimentaux se base t-on pour conclure quand au démarrage de la réaction ? La réaction est exothermique : l'éther entre en ébullition.
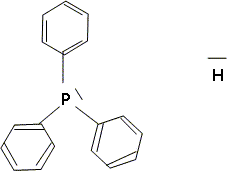
Complexe du type AX4E2 : plan carré. Dans le complexe C, le rhodium a une structure stable avec une couche externe à 18 électrons avec, entre autres, deux ligands hydrure et un ligand triphénylphosphine PPh3. Justifier en donnant une formule de Lewis que la triphénylphosphine puisse bien jouer le rôle de ligand, de même que l'ion hydrure. Ils possèdent tous deux un doublet d'électrons libres.
Justifier la stabilité des structures à 18 électrons pour les complexes des métaux de transition. Configuration électronique équivalente à celle des gaz nobles. Réaction d'échange de ligand en solution aqueuse. Les réactions d'échange de ligands sont aussi très courantes avec les complexes ionrganiques en solution aqueuse. On s'intéresse à la réaction d'échange de ligands en solution aqueuse sur un complexe du fer. Dans un bécher contenant 100 mL d'une solution d'ion Fe3+ à la concentration c0 = 0,10 mol/L, on ajoute 0,010 mol de thiocyanate de potassium solide KSCN(s). La variation de volume est négligeable par rapport au volume initial. Il se forme le complexe Fe(SCN)2+ (aq). Fe3+ (aq) + SCN- (aq) = Fe(SCN)2+ (aq) ; constante de formation ß1=102,3. Quel est le nom du complexe formé ? cation thiocyanatofer(III).
102,3 = 200 =0,1 x /(0,01-x)2 ; résoudre : x = 8,0 10-3 mol. [Fe(SCN)2+] = 0,08 mol/L ; [Fe3+]=[SCN-] =0,02 mol/L.
|
||||||||||||||||||||||||||||||||||||||||
|
|